
 敬请关注公众号
敬请关注公众号

基因信息
Locus编号:AT5G15840
常用名称:CONSTANS, CO
其它名称:B-BOX DOMAIN PROTEIN 1, BBX1
基因功能
CO位于细胞核,编码一种与锌指转录因子相似的蛋白质,直接结合在FLOWERING LOCUS T (FT)的启动子区域,激活FT的转录,参与长日照开花的调控。
突变体信息
co突变体的表型多表现为在长日照下延迟开花,在短日照下开花时间与野生型差不多甚至略早于野生型。在国内拟南芥突变体共享中心AraShare中有三个FT突变体,NASCode分别为N2102379、N2102380、N2102381,可通过www.arashare.cn征订。
基因表达谱
已有的研究通过RT-PCR、RNA原位杂交、组织化学染色等手段研究CO的时空表达模式。RT-PCR结果显示CO的表达受到生物钟和光照时间的调控,表达量呈周期性变化;原位杂交结果显示CO的mRNA在顶端分生组织及幼嫩的叶原基中表达;组织化学染色结果显示CO主要在下胚轴的维管组织、子叶及嫩叶中,在成熟的叶片中,CO仅在维管组织中表达。
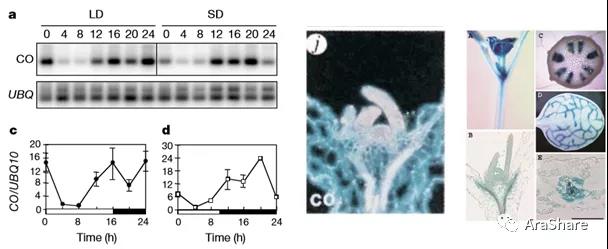
图1.CO的表达模式分析
笔者进一步检查eFP browser网站上对CO基因在拟南芥不同组织中的表达模式,RNA-seq数据如图2所示。
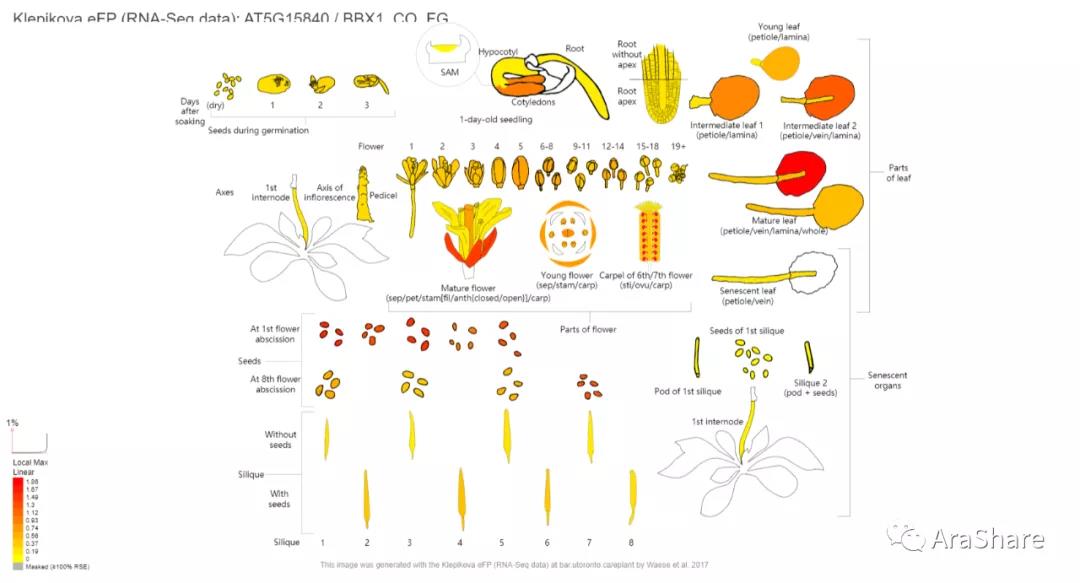
图2.拟南芥中CO基因表达谱(来自eFP browser)
研究概况
植物通过对光周期的感知来感受季节变化进而调控像开花这样重要的发育转变。CO即处在光周期途径的枢纽位置,同时整合外部环境和植物内部信号调控开花。
CO的发现
1995年Coupland等人分析12个晚花突变体,并根据这些突变体对春化、日照时间、光质等因素的响应将他们进行分类。其中,co突变体在长日照下比野生型开花晚,在短日照下与野生型开花时间类似,并且对春化响应的敏感度大大降低。他们通过图位克隆的方法首次将CO克隆出来,发现其蛋白序列含有锌指结构域。将CO基因在野生型中过表达发现在长日照下纯合子的开花时间早于杂合子,因此CO在长日照下促进开花还具有剂量效应[1]。
CO在促进开花中的作用
1、初步建立CO参与的开花途径调控网络
CO能够影响开花时间,而开花直接受到花顶端分生组织特征基因APETALA1(AP1)和LEAFY(LFY)的影响,那么CO与AP1和LFY是什么关系?与抑制AP1和LFY的TERMINAL FLOWR (TFL)又有什么关系?为了回答这些问题,Coupland教授在拟南芥中过量表达CO来检查CO如何调控花分生组织特征基因的转录。因为CO的表达受到光照时长的调控,为了使CO的表达不受光照时长及发育阶段的限制,作者巧妙地设计了一个过表达载体35S::CO:GR,并将该载体通过农杆菌介导,转入co-2突变体中表达。在该载体中,作者使用强启动子35S驱动CO组成型表达,绝妙的是,作者在CO末端接入了大鼠糖皮质激素受体(rat glucocorticoid receptor),在没有甾体配体的情况下,该受体可以使植物转录因子失活,但在配体地塞米松的存在下,蛋白质的活性又能得以恢复。他们的研究结果表明不管是在长日照还是短日照的条件下,在不同的发育阶段过量表达CO均可以促进开花。为了探究CO对花分生组织特征基因的影响,作者通过RNA原位杂交检查LFY、TFL以及AP1在转基因植株中的表达模式,结果显示,在长日照下CO可以直接激活TFL和LFY的表达而不能直接激活AP1的表达,即CO直接作用于TFL和LFY的上游,对AP1起间接调控作用。尽管TFL可以抑制开花,但是过量表达CO足以使其抑制作用消除[2]。

图3.CO:GR co-2转基因拟南芥响应地塞米松处理的表型(图片来自Coupland等研究结果[2])。
所有材料均生长了31天,a-f在长日照下生长,f-j在短日照下生长。图中的天数表示在生长的第几天给予地塞米松处理。
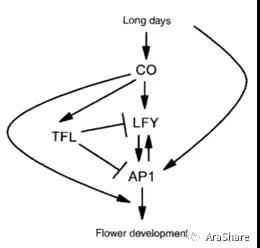
图4.1996年Coupland等人初步建立的CO调控网络
2、关系重新梳理——CO与FT、SOC1的“关系确立”
科学的进步在于基于之前的研究对已取得的研究结果的完善与修订。2000年,Coupland基于前文建立的实验体系,对研究方法加以完善,在原本的实验中,作者只用地塞米松激活35S::CO:GR构建的表达,在2000年的研究中,作者在转基因拟南芥中除了使用地塞米松,同时还用了转录抑制剂环己酰亚胺(cycloheximide)。二者同时使用时,融合蛋白只会影响CO直接调控的目标基因,而不会影响更下游基因的表达。通过该实验体系,作者发现FT、SOC1、AtP5CS2、ACS10受到CO的直接调控,而非之前鉴定的AP1与LFY。其中FT和SOC1促进开花,并且FT和SOC1还参与开花的春化途径。而ACS10参与乙烯的合成,AtP5CS2参与脯氨酸的合成,即CO还参与其它生物学过程。基于此研究结果,Coupland教授重构了CO参与调控的开花网络(图5)。
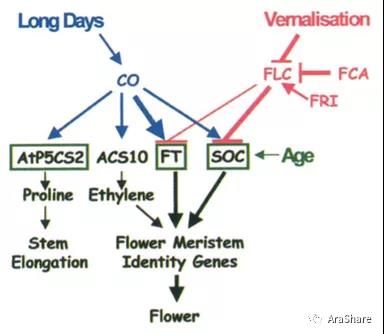
图5.2000年Coupland等人重构CO调控网络[3]
3、关系再梳理——CO通过FT调控SOC1
每一个科学问题都是经过多个科学家多年的研究才得以解答。2005年,Seung Kwan Yoo等人发现Coupland等人之前之所以认为FT和SOC1位于CO的下游处于平行的两条途径行使功能,是因为他们分析了一个表型比较弱的ft突变体。Kwan Yoo等人发现一个新的突变位点ft-10,该突变体能够完全抑制CO过表达植株的早花表型,然而soc1-2只能部分抑制CO的表型,说明FT是CO的主要的下游基因。在FT功能获得或缺失突变中,SOC1的表达量受到影响,然而在SOC1突变体中,FT的表达却不受影响,表明SOC1受到FT的调控。此外,即便在CO过表达植株中,抑制FT的表达同时也能使SOC1的表达量下调,表明CO要通过FT激活SOC1的表达。基于此结果,他们对CO的调控网络进行了进一步的调整(图7)[4]。
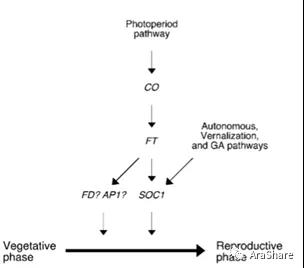
图6.CO调控网络的进一步调整[4]
CO同时参与生物钟与开花的调控
之前已有的研究结果表明,CO在长日照下促进开花,那CO是如何响应日长变化调控开花的呢?2001年,Coupland教授的另一个重要研究成果回答了这个问题。对开花的多年研究经验使Coupland教授关注到很多突变体会同时影响拟南芥的生理节律和开花时间(如lhy、gi、elf3),但是当时并不清楚这些影响生物钟的突变体是如何影响开花的。Coupland教授通过分析CO的表达模式发现CO的表达受到节律基因LHY和GI的调控呈周期性变化,并且直接受CO调控的目标基因FT的表达与CO的表达周期类似。该发现首次建立起生物节律与植物开花之间的联系,CO在其中起到中枢作用[5]。
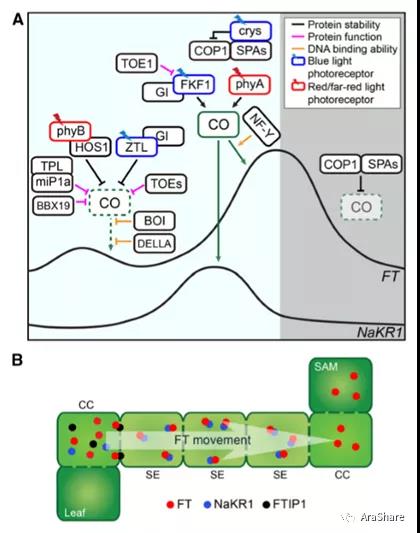
图7.CO对FT表达的调控依赖光周期变化[6]
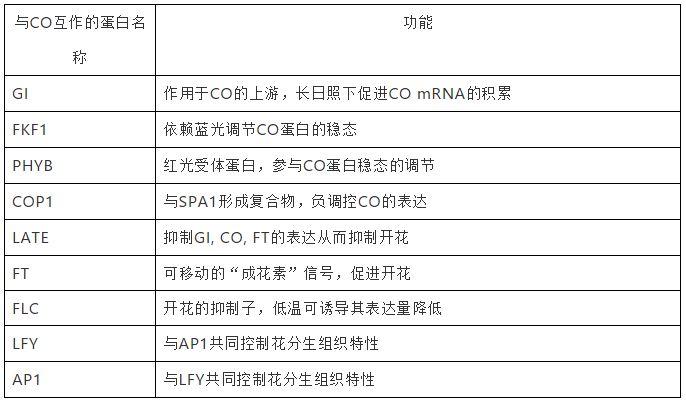
在长日照下,拟南芥具有多种以CO为中心的调控机制诱导FT在下午表达。在早上,CO蛋白的峰度及其活性被与其相互作用的蛋白下调。在调控CO蛋白降解方面,一方面,红光受体蛋白phyB与E3泛素连接酶形成复合物降解CO;另一方面,蓝光受体蛋白ZTL与GI一起负调控CO。在调控CO转录抑制方面,一方面,两个含有B-BOX结构域的蛋白BBX19和miP1a均在早上高度表达并抑制CO的转录,其中,miP1a通过招募转录抑制子TPL行使功能;另一方面,两个含有AP2结构域的蛋白TOE1和TOE2在早上也可以和CO形成复合物抑制CO的活性。此外,有研究表明GA信号途径的关键抑制子DELLA蛋白可以和CO互作,阻碍CO与NF-Y的结合进而抑制CO的功能。GA信号通路中的另一个蛋白BOI也可以与CO互作,但是它不直接影响CO的活性而是与CO竞争性地结合FT启动子进而影响CO的功能。在下午,CO蛋白的稳定表达受到两类蓝光感受器的调控,即Crys和FKF1蛋白。Crys通过负调控可降解CO的蛋白复合物COP1-SPA的表达促进CO的积累。FKF1依赖蓝光可能与GI、CO共同形成三元复合物维持CO的活性。此外,吸收远红外光的红光受体phyA可能也参与维持CO的稳态。CO蛋白一旦积累则可以激活FT的转录。NF-Y复合物可以促进CO与FT启动子的结合。CO在长日照的下午还可以激活转运FT的基因NaKR1的表达。在夜间,COP1-SPA复合物降解CO蛋白,因此FT的表达也在夜间受到抑制。
基因网络
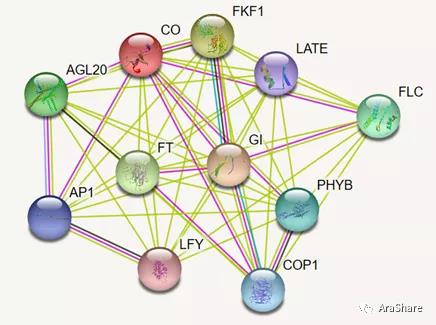
图8.STRING预测FT蛋白互作网络
CO在开花光的周期途径中发挥总指挥的作用,与其互作的蛋白包括调控它的光受体蛋白以及它调控的开花光周期途径中的其它蛋白。
其他物种研究情况简介
水稻是典型的短日照作物,水稻中CO的同源基因为Heading date 1(Hd1),在短日照下Hd1通过诱导FT的同源基因Hd3a促进抽穗[7]。此外,在土豆中,CO的同源基因StCO与StSP6A(FT的同源基因)共同调控块茎的起始[8]。这暗示,由CO和FT组成的光周期调控途径不仅参与植物开花,在分生组织相关转变中也发挥重要的功能。葡萄中两个CO的同源基因VvCO和VvCOL1的表达模式均呈周期性变化,且在黄昏时分表达量达到峰值。在葡萄花蕾的发育过程中,VvCOL1主要在休眠期表达而VvCO主要在潜芽期表达。此外,研究还表明VvCO的表达模式与VFY和VvMADS8(分别为拟南芥LFY和SOC1的同源基因)的表达具有相关性,说明VvCO参与了葡萄开花的季节性变化[9]。
展望
CO作为开花光周期途径的关键调控基因与FT一起行使功能,二者组成的调控途径除了参与开花,在器官发育如块茎膨大过程中也发挥作用。尽管CO-FT在调控开花方面的功能研究较为深入,但是二者参与的其它功能还有待进一步研究。比如,植物分生组织相关转变(开花、块茎起始、块根膨大等)是否都招募了CO-FT?CO-FT组成的调控途径还会调控下游哪些基因?
参考文献:
[1] Joanna Putterill, Frances Robson, Karen Lee, Rüdiger Simon, George Coupland. The CONSTANS Gene of Arabidopsis Promotes Flowering[J].Cell,1995,80(6):847-857.
[2] Rüdiger Simon, M.Isabel Igeño, George Coupland, et al. Activation of floral meristem identity genes in Arabidopsis[J].Nature,1996,384(6604):59-62.
[3] Alon Samach1, Hitoshi Onouchi1, Scott E. Gold, et al. Distinct Roles of CONSTANS Target Genes in Reproductive Development of Arabidopsis[J].Science,2000,288 (5471):1613-1616.
[4] Yoo S K, Chung K S,Kim J, et al. CONSTANS activates SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1through FLOWERING LOCUS T to promote flowering in Arabidopsis[J].Plant Physiol,2005,139(2):770-778.
[5] Suárez-López P, Wheatley K, Robson F, Onouchi H, Valverde F, Coupland G. CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis[J].Nature,2001,410(6832):1116-1120.
[6] Shim J S, Kubota A,Imaizumi T. Circadian Clock and Photoperiodic Flowering in Arabidopsis: CONSTANSIs a Hub for Signal Integration[J].Plant Physiol,2017, 173(1): 5-15.
[7] Masahiro Yano, Yuichi Katayose, Motoyuki Ashikari, et al. Hd1, amajor photoperiod sensitivity quantitative trait locus in rice, is closelyrelated to the Arabidopsis flowering time gene CONSTANS[J].The Plant Cell,2000,12(12)2473-2483.
[8] Navarro C, AbelendaJ A, Cruz-Oro E, et al. Control of flowering and storage organ formation inpotato by FLOWERING LOCUS T[J].Nature,2011,478(7367):119-122.
[9] Almada R, Cabrera N, Casaretto J A, et al. VvCO and VvCOL1, twoCONSTANS homologous genes, are regulated during flower induction and dormancyin grapevine buds[J].Plant Cell Rep,2009,28(8):1193-1203.
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!