
 敬请关注公众号
敬请关注公众号

蛋白激酶是细胞生理活动诸多进程的参与者。丝裂原活化蛋白激酶MAPK家族成员已被广泛证明参与调控真核生物的抗病途径,并在其中扮演着至关重要的角色。
位点简介
Locus:At4g01370
Name:Mitogen-activated proteinkinase 4
基因功能
植物免疫信号转导过程中,宿主细胞通过受体对病原菌组分进行“非我”的识别并通过一系列的细胞内的组分进行信号传递。MAPK级联在该传递过程中起特异性的信号放大作用。MPK4作为级联中的成员通过不同类型的底物发挥调控作用。MPK4突变后在主要影响植物抗病能力。此外根据底物的不同,MPK4还涉及调控细胞分裂、根发育、高光响应、非生物胁迫等途径。
基因表达谱
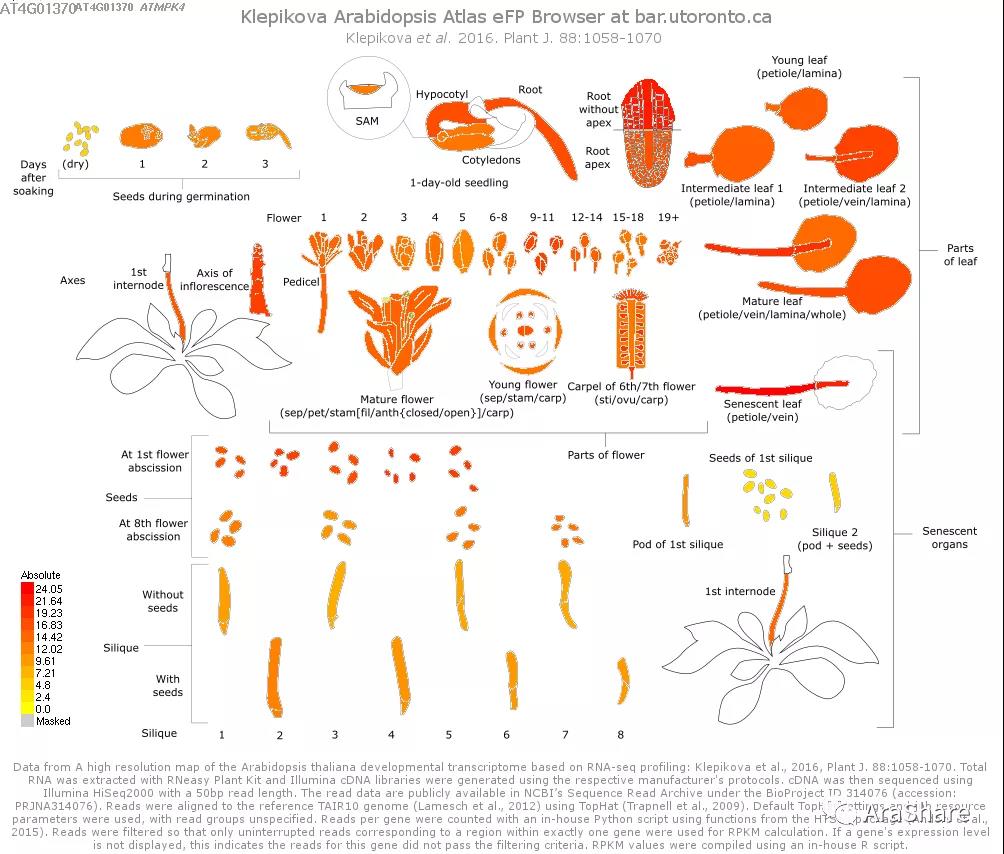
图1 拟南芥中MPK4基因表达谱
(Source: eFP Broswer from http://www.bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)
蛋白互作网络
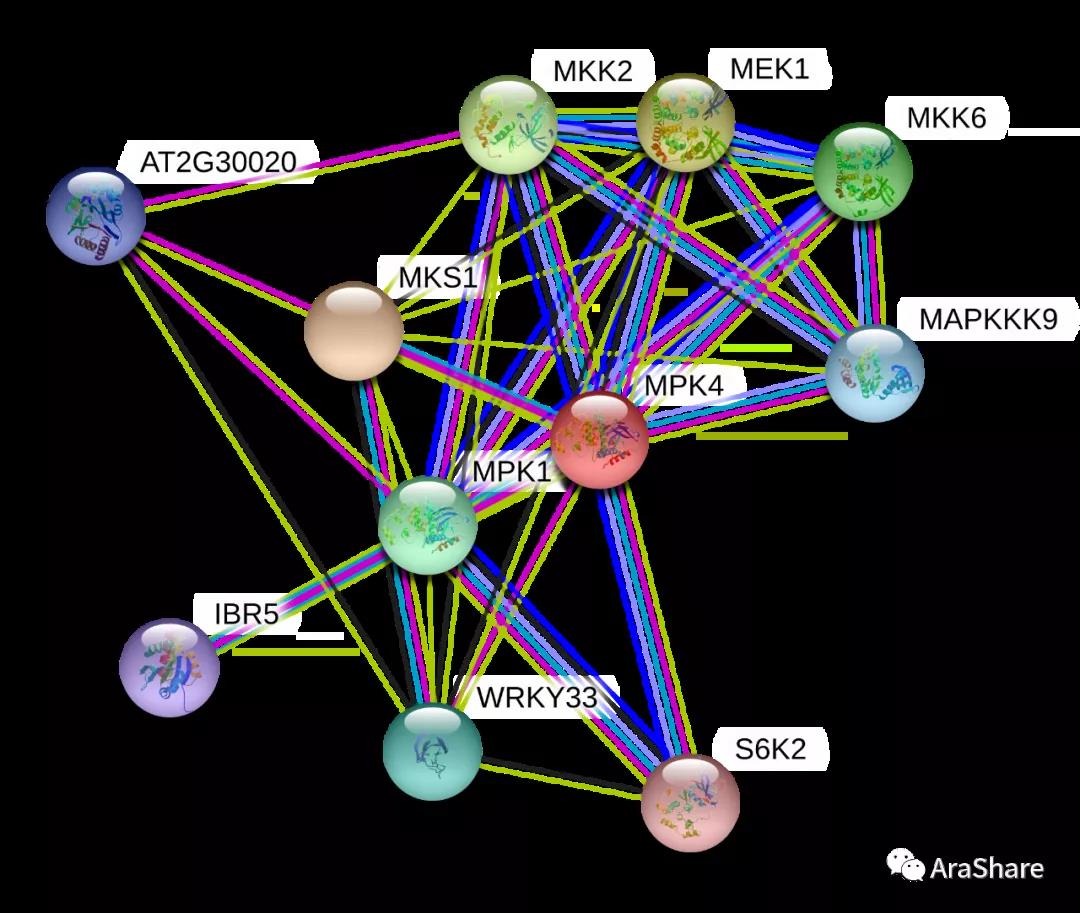
图2 预测MPK4蛋白互作网络(Source: STRING from https://string-db.org/)
研究概况与展望
登上诺贝尔奖殿堂的可逆磷酸化研究
当1992诺贝尔生理学奖授予美国科学家埃德蒙·费希尔(Edmond H. Fischer)与埃德温·克雷布斯(Edwin G. Krebs),以表彰两位在“发现可逆的蛋白质磷酸化作用是一种生物调节机制”中做出的卓越贡献。委员会在授奖时对两位的工作做出展望并这样说道“我们现如今估计整个(人类)基因组约有1 %的基因编码激酶,而这些激酶则能够调节细胞内成千上万蛋白质的功能”。诚然,从今天看来,激酶的重要性已无需多言,毕竟其参与调控如此众多生命过程。从动物到植物研究领域,从正常的生长发育到应对病原入侵的免疫过程,毫不夸张的说,激酶与细胞乃至有机整体“生死攸关”。
丝裂原活化蛋白激酶(MAPK: Mitogen-activated proteinkinase)家族是真核生物中一类非常保守的信号转导节点。其通常位于受体(感应器)下游,起呈递已接收细胞外刺激信号并转换为胞内响应的功能。植物MAPK级联在宿主应对病原入侵的过程中起至关重要的作用,本文将着眼于拟南芥MPK4,对其研究历史进行小结以飨读者。
拟南芥MPK4的研究起源
本世纪初丹麦哥本哈根大学(Copenhagen University)的John Mundy研究团队在Cell上刊文报道了一个生长呈极其矮小表型的突变体[1](见图3)。在基因组水平发现该突变体由转座子插入在MPK4基因的第一内含子临近第二外显子处所造成。奇怪的是,利用Northern杂交的方式发现mpk4中对非生物胁迫以及激素处理的响应能力与野生型相比并无显著差异。联想到一些抗病防卫反应组成型激活的突变体(例如cpr1)通常也会发生极端矮小,叶片卷曲的表型。作者遂在mpk4中接种模式植物模式病原菌丁香假单胞菌番茄致病变种(Pst DC3000)以及寄生霜霉(Peronospora parasitica isolate Cala2)后,发现mpk4对这两种毫无关联的病原菌都表现出非常高的抗性,因此预示着MPK4是特异参与免疫信号通路调控。随后,在分子水平上作者发现mpk4中PR基因呈现组成型表达状况。而在生理水平上,与活体营养型病原的抗病性相关的激素水杨酸(SA)也在mpk4中大量积累。如果在该突变体中引入细菌编码的水杨酸羟化酶nahG,人为降低SA积累水平后,mpk4 nahG的生长表型会部分恢复,而对病原菌的抗性则显著下降。此外mpk4中与腐生型病原菌相关的激素JA所诱导相关标记基因的表达能力也完全丧失,利用mpk4 nahG发现,该现象是MPK4特异调控的,与其体内高浓度积累的SA无关。根据以上诸多表型可以看出MPK4在免疫信号中起着至关重要的调控作用。由此,植物抗病领域的一颗明星“冉冉升起”。

图3 mpk4成苗的矮化表型[1]
免疫信号中MPK4的下游组分
MPK4作为激酶,必然通过特定的底物来调控植物免疫进程。Mundy研究团队以此为出发点采用反向遗传学策略,利用酵母文库筛选手段成功的找到其底物MKS1 (MAP kinase 4 substrate 1)并将研究发表在2005年的EMBO Journal[2]。该研究报道MPK4可以与MKS1互作,并在体内以及体外条件下磷酸化MKS1。表型以及遗传学分析发现,超表达MKS1后,无论是生长表型,还是PR基因的表达亦或是抗病能力,35S:MKS1均介于WT与mpk4之间(见图4)。而在mpk4中利用RNA干扰MKS1的表达,发现mpk4 MKS1-RNAi部分恢复了mpk4的矮小表型,相应地对病原菌的抗性也要弱于mpk4。以上结果都说明MKS1作为MPK4免疫信号调控过程的底物之一参与植物抗病。
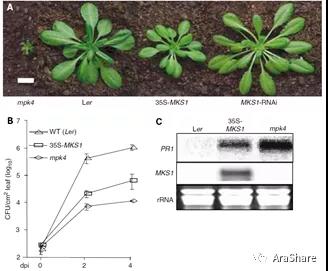
图4 MKS1相关的表型[2]
A) 成 苗的生长表型;B) 成苗对病原菌Pst DC3000的抗性差异;C) 成苗中PR基因的表达结果
由于MKS1的生化功能未知,因此Mundy团队继续在MKS1上进行探索,历时三年将研究结果发表在2008年的EMBO Journal[3]。研究发现MKS1与转录因子WRKY33可以共同调控下游植保素(Camalexin)合成基因PAD3的表达。通过一系列生化实验,作者证明在正常生理状态下,MPK4与MKS1以及WRKY33形成复合体(见图5),将WRKY33隔离使其无法进行转录调控。在病原菌入侵后,MPK4的激活可以磷酸化MKS1,MKS1/WRKY33随之与MPK4解离,调控PAD3等基因的表达。至此,研究人员在免疫信号研究当中探明了一条由MPK4以及其底物并通过下游核内靶基因调控的通路。
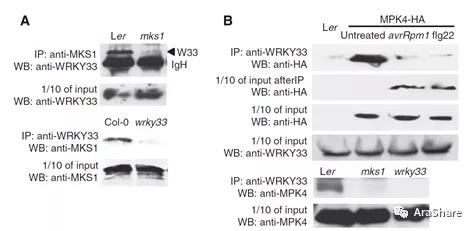
图5 MPK4与MKS1和WRKY33形成复合体[3]
A) 核内提取物中WRKY33与MKS1的Co-IP结果;B) 病原菌Pst DC3000 (avrRpm1)或flg22处理前后,WRKY33和MPK4的Co-IP结果
免疫信号中MPK4的上游组分
MAPK作为一个胞内的级联信号,要进一步明确MPK4级联如何参与免疫信号调控就需要涉及两个问题,其一是免疫信号转导过程中MPK4级联上游的MAPKK以及MAPKKK是谁;其二是免疫信号如何从胞外传递至胞内MAPKKK?针对前一个问题,2006年底以及2007初,时年在John Innes Centre的Ken Shirasu Group以及University of Wisconsin的Patrick J. Krysan Group报道MEKK1的功能缺失突变体中,PAMP(flg22)无法激活MPK4[4][5]。因此表明在抗病信号通路中,MEKK1是MPK4级联信号的上游组分。确定了MAPKKK之外还要确定MAPKK。同样也是在2006-07年的时间节点上,La´szlo´ Bo¨gre Group报道mkk1影响PAMP对MPK4的激活[6]。而Heribert Hirt Group则报道使用MKK2-EE(组成型激活形式)植株可以增强病原对MPK4的激活能力[7]。以上结果暗示着MKK1或MKK2应该是MPK4上游的MAPKK。需要注意的是,在生长表型上mekk1为类似mpk4的矮小表型,但mkk1和mkk2(或MKK2-EE)均与野生型无异。有鉴于此,Mundy Group以及张跃林研究团队分别得到mkk1 mkk2的双突[8][9],同时发现该双突与mekk1或mpk4的诸多表型一致,例如植株矮小,PR基因上调,抗病能力提高等。MundyGroup利用转录组分析手段得到受mekk1,mkk1 mkk2,mpk4共同调控多为PR、camalexin以及SA合成相关基因(见图6)[8]。而张跃林团队则利用生化手段证明在植物体内MKK1/MKK2与MEKK1和MPK4均能够互作[9]。至此,研究人员清晰诠释出一条参与植物免疫途径调控的完整MAPK级联(即MEKK1-MKK1/MKK2-MPK4)。
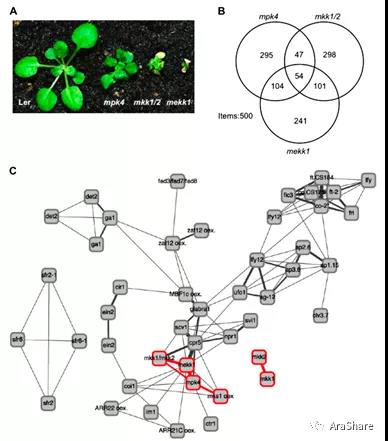
图6 MEKK1、MKK1/2、MPK4调控同一免疫信号通路[8]
A) mekk1、mkk1/2、mpk4的生长表型;B) Venn图显示三种突变体中受调控的基因数量;C) The functional association(s) by responseoverlap (FARO) genotype graph显示各种突变体(或过表达)中基因表达特征
而关于信号识别并传递至MAPKKK的第二个问题。周俭民研究团队经过多年研究在2018年于Plant Cell上刊文证明免疫信号的膜受体可以借由RLCK VII-4 亚家族成员将胞外的免疫信号传递至MAPK级联(见图7)[10]。
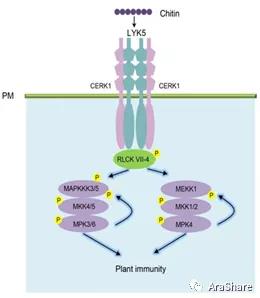
图7 膜受体识别Chitin并经由RLCK VII-4激活MPK4以及MPK3/6级联示意图[10]
结合近20年左右的研究成果,完整的植物免疫信号转导由细胞表面的膜受体如FLS2识别PAMP(病原相关分子模式)并招募共受体BAK1起始,信号由此传递至胞内经由RLCK VII-4激活MEKK1-MKK1/MKK2-MPK4信号级联,并借由MPK4底物MKS1/WRKY33启动抗病响应基因(例如PAD3等)的表达最终完成植物抗病的调节过程。
其它信号中MPK4参与的调控途径
正如开篇所述,细胞内的激酶数量有限,却能够调控诸多生理进程。这样的过程自然是依靠底物来实现。因此,利用蛋白质互作筛选确定MPK4底物是MPK4功能研究的方向之一。从2000年开篇报道MPK4以来,除去以上已详细论述过的MKS1之外,经验证并发表的MPK4底物还包括:ASR3[11]、PAT1[12]、GTL1[13]、ERF8[14]、MAP65-1[15]、MYB75[16]、MYB42[17]等。MPK4协同这类底物除参与抗病信号以外还在细胞分裂、光信号介导的花青素合成、盐胁迫等途径中发挥作用。
近年来,有文章报道MPK4还参与植物气孔的动态响应,由于该方向中MPK4的调控作用较为特别且具开创性前景,因此我在此单独进行叙述:该方向起源自当年Mundy Group首次报道MPK4时的一个非常有意思的结果,即是在成苗中MPK4的表达主要在叶片的气孔当中[1]。这也就暗示着MPK4可能还与气孔的生理响应相关。由于mpk4突变体因自身免疫而表现出极端矮小的表型,因此对气孔的相关分析产生了诸多限制。在RNAi技术逐步成熟后,结合特异启动子实现特定组织中基因表达的调控已成为可能。有鉴于此,2016年Hannes Kollist Group于Plant Cell上刊文报道使用microRNA在气孔中特异干扰MPK4/MPK412的表达[18],植物气孔对高浓度CO2的响应能力出现缺陷。作者进一步证实MPK4/MPK12可以与气孔中HT1互作,并通过抑制HT1对底物GHR1的磷酸化过程,从而实现CO2诱导的气孔响应调控过程。由于HT1对气孔运动调控的底物GHR1、SLAC1、OST1也是ABA信号调控的通路组分。因此MPK4/HT1的对气孔运动调控的通路是否响应ABA也需要进一步探索。随后,2018年以上研究团队与Julian I.Schroeder Group在Plant Journal上报道[19],利用膜片钳技术证明MPK4协同MPK12对阴离子通道(例如SLAC1)的激活响应CO2/bicarbonate,而与ABA无关。该文同时发现CO2/bicarbonate并不影响MPK4的激酶活性,因此MPK4如何响应CO2是一个亟待解决的关键问题。
有鉴于此,波兰Łukasz Gałgański Group进行了相关研究并在今年将成果率先发表在预印本bioRxiv[20]。文章报道通过优化实验条件等方式可以实现CO2在体内以及体外条件下激活MPK4。此外利用同位素标记CO2并使用液体闪烁计数的手段证明MPK4可以结合CO2。由于该文同时证明CO2对MPK4的激活不受MAPKK抑制物的影响,因此作者认为MPK4是CO2的受体。如果该研究能够通过同行评议并正式刊文的话,可以想象这必然是极具理论突破性的成果!
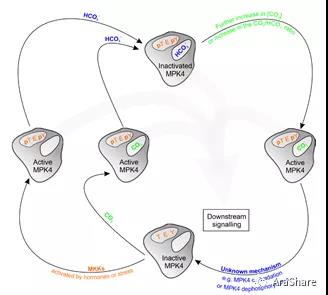
图8 MPK4响应高浓度CO2/HCO3-的假设工作模型[20]
今后的研究展望
今年距MPK4的第一篇文章刚好过去20年,近年来关于MPK4的研究热点主要集中在两个方向:其一是互作网络筛选的过程,通过鉴定不同类型的底物,针对底物参与的信号通路进行详细研究。该方向面对的研究挑战即是,探明在瞬息万变的外界环境下MPK4如何维持其自身对信号识别并进行传递的特异性。此外,通过正向遗传学手段筛选MPK4级联自身免疫表型的抑制子也是研究热点之一。在该领域,加拿大不列颠哥伦比亚大学(University of British Columbia)张跃林团队取得了诸多关键性突破成果:SUMM(Suppressor of MKK1 MKK2)系列基因的功能产物已被广泛证明位于MPK4下游并对其自身免疫途径起调控作用。我们有理由期待在将来能够看到更为精细且令人惊叹的MPK4级联免疫调控网络。
突变体信息
常用MPK4 T-DNA类插入突变体为mpk4-2(SALK_056245) allele,插入位点位于MPK4第6外显子之上,导致基因表达Knock out[21]。其它常用MPK4突变体有mpk4-1/-3。其中mpk4-1 allele为Landsberg背景中Ds-tagged插入形式。mpk4-3为Col-0中EMS诱变的点突形式。以上突变体在Arashare中现无相关种质资源,欢迎您捐赠。
参考文献
[1] Petersen, M.; Brodersen, P.; Naested, H.;Andreasson, E.; Lindhart, U.; Johansen, B.; Nielsen, H. B.; Lacy, M.; Austin,M. J.; Parker, J. E.; Sharma, S. B.; Klessig, D. F.; Martienssen, R.; Mattsson,O.; Jensen, A. B. & Mundy, J., Arabidopsis MAP Kinase 4 Negatively Regulates Systemic Acquired Resistance, Cell, 2000
[2] Andreasson, E.; Jenkins, T.; Brodersen, P.;Thorgrimsen, S.; Petersen, N. H.; Zhu, S.; Qiu, J.-L.; Micheelsen, P.; Rocher,A.; Petersen, M.; Newman, M.-A.; Bjørn Nielsen, H.; Hirt, H.; Somssich, I.;Mattsson, O. & Mundy, J., The MAP kinase substrate MKS1 is a regulator of plant defense responses, The EMBO Journal, EMBO Press, 2005
[3] Qiu, J.-L.; Fiil, B. K.; Petersen, K.; Nielsen,H. B.; Botanga, C. J.; Thorgrimsen, S.; Palma, K.; Suarez-Rodriguez, M. C.; Sandbech-Clausen, S.; Lichota, J.; Brodersen, P.; Grasser, K. D.; Mattsson, O.;Glazebrook, J.; Mundy, J. & Petersen, M., Arabidopsis MAP kinase 4 regulates gene expression through transcription factor release in the nucleus, The EMBO Journal, 2008
[4] Ichimura, K.; Casais, C.; Peck, S. C.; Shinozaki, K. & Shirasu, K., MEKK1 Is Required for MPK4 Activation and Regulates Tissue-specific and Temperature-dependent Cell Death in Arabidopsis, Journal of Biological Chemistry, 2006
[5] Suarez-Rodriguez, M. C.; Adams-Phillips, L.; Liu, Y.; Wang, H.; Su, S.-H.; Jester, P. J.; Zhang, S.; Bent, A. F. & Krysan, P. J., MEKK1 Is Required for flg22-Induced MPK4 Activation in Arabidopsis Plants, Plant Physiology, 2007
[6] Mészáros, T.; Helfer, A.; Hatzimasoura, E.; Magyar, Z.; Serazetdinova, L.; Rios, G.; Bardóczy, V.; Teige, M.; Koncz, C.; Peck, S. & Bögre, L., The Arabidopsis MAP kinase kinase MKK1 participates in defence responses to the bacterial elicitor flagellin, The Plant Journal, 2006
[7] Brader, G.; Djamei, A.; Teige, M.; Palva, E. T.& Hirt, H., The MAP Kinase Kinase MKK2 Affects Disease Resistance in Arabidopsis, Molecular Plant-Microbe Interactions, 2007
[8] Qiu, J.-L.; Zhou, L.; Yun, B.-W.; Nielsen, H.B.; Fiil, B. K.; Petersen, K.; MacKinlay, J.; Loake, G. J.; Mundy, J. & Morris, P. C., Arabidopsis Mitogen-Activated Protein Kinase Kinases MKK1 and MKK2 Have Overlapping Functions in Defense Signaling Mediated by MEKK1, MPK4,and MKS1, Plant Physiology, 2008
[9] Gao, M.; Liu, J.; Bi, D.; Zhang, Z.; Cheng, F.; Chen, S. & Zhang, Y., MEKK1, MKK1/MKK2 and MPK4 function together in amitogen-activated protein kinase cascade to regulate innate immunity in plants, Cell Research, 2008
[10] Bi, G.; Zhou, Z.; Wang, W.; Li, L.; Rao, S.; Wu, Y.; Zhang, X.; Menke, F. L.; Chen, S. & Zhou, J.-M., Receptor-like Cytoplasmic Kinases Directly Link Diverse Pattern Recognition Receptors to the Activation of Mitogen-activated Protein Kinase Cascades in Arabidopsis, ThePlant Cell, 2018
[11] Li, B.; Jiang, S.; Yu, X.; Cheng, C.; Chen,S.; Cheng, Y.; Yuan, J. S.; Jiang, D.; He, P. & Shan, L., Phosphorylation of Trihelix Transcriptional Repressor ASR3 by MAP KINASE4 Negatively Regulates Arabidopsis Immunity, The Plant Cell, 2015
[12] Roux, M. E.; Rasmussen, M. W.; Palma, K.; Lolle, S.; Regué, À. M.; Bethke, G.; Glazebrook, J.; Zhang, W.; Sieburth, L.; Larsen, M. R.; Mundy, J. & Petersen, M., The mRNA decay factor PAT1 functionsin a pathway including MAP kinase 4 and immune receptor SUMM2, The EMBO Journal, 2015
[13] Völz, R.; Kim, S.-K.; Mi, J.; Mariappan, K.G.; Guo, X.; Bigeard, J.; Alejandro, S.; Pflieger, D.; Rayapuram, N.;Al-Babili, S. & Hirt, H., The Trihelix transcription factor GT2-like 1(GTL1) promotes salicylic acid metabolism, and regulates bacterial-triggered immunity, PLOS Genetics, 2018
[14] Cao, F. Y.; DeFalco, T. A.; Moeder, W.; Li,B.; Gong, Y.; Liu, X.-M.; Taniguchi, M.; Lumba, S.; Toh, S.; Shan, L.; Ellis,B.; Desveaux, D. & Yoshioka, K., Arabidopsis ETHYLENE RESPONSE FACTOR 8(ERF8) has dual functions in ABA signaling and immunity, BMC PlantBiology, 2018
[15] Beck, M.; Komis, G.; Müller, J.;Menzel, D. & v Samaj, J., Arabidopsis Homologs of Nucleus- and Phragmoplast-Localized Kinase 2 and 3 and Mitogen-Activated Protein Kinase 4 Are Essential for Microtubule Organization, The Plant Cell, 2010
[16] Li, S.; Wang, W.; Gao, J.; Yin, K.; Wang, R.; Wang, C.; Petersen, M.; Mundy, J. & Qiu, J.-L., MYB75 Phosphorylation by MPK4 Is Required for Light-Induced Anthocyanin Accumulationin Arabidopsis, The Plant Cell, 2016
[17] Sun, Y.; Zhao, J.; Li, X. & Li, Y., E2 conjugases UBC1 and UBC2 regulate MYB42-mediated SOS pathway in response tosalt stress in Arabidopsis, New Phytologist, 2020
[18] Hõrak, H.; Sierla, M.; Tõldsepp, K.;Wang, C.; Wang, Y.-S.; Nuhkat, M.; Valk, E.; Pechter, P.; Merilo, E.; Salojärvi,J.; Overmyer, K.; Loog, M.; Brosché, M.; Schroeder, J. I.; Kangasjärvi, J.& Kollist, H., A Dominant Mutation in the HT1 Kinase Uncovers Roles of MAP Kinases and GHR1 in CO2-Induced Stomatal Closure, The Plant Cell, 2016
[19] Tõldsepp, K.; Zhang, J.; Takahashi, Y.;Sindarovska, Y.; Hõrak, H.; Ceciliato, P. H.; Koolmeister, K.; Wang, Y.-S.;Vaahtera, L.; Jakobson, L.; Yeh, C.-Y.; Park, J.; Brosche, M.; Kollist, H.& Schroeder, J. I., Mitogen-activated protein kinases MPK4 and MPK12 are key components mediating CO2-induced stomatal movements, The Plant Journal, 2018
[20] Gałgaʼnska, H. & Gałgaʼnski, Ł., Mitogen-activated protein kinases arecarbon dioxide receptors in plants, bioRxiv, 2020
[21] Xing, Y.; Jia, W. & Zhang, J., AtMKK1 mediates ABA-induced CAT1 expression and H2O2 production via AtMPK6-coupledsignaling in Arabidopsis, The Plant Journal, 2008
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!