
 敬请关注公众号
敬请关注公众号

平衡逆境响应与正常生长是植物面对时刻变化的外界环境时所必须具备的能力。目前研究针对胁迫响应信号组分如何参与生长调控的部分较少。COR27、COR28作为低温响应因子,同时两者具备生物钟系统调控的功能,并能够与光信号组分协同作用调节特定植物生长过程。
位点简介
Locus: At5g42900; Name: COR27 Cold-regulated gene 27
Locus: At4g33980; Name: COR28 Cold-regulated gene 28
基因功能
植物的低温响应涉及ICE1-CBFs-CORs级联,正向调控植物的低温耐受能力。而COR27和COR28的表达虽然响应低温,基因功能缺失则造成植株低温敏感表型,同时影响生物节律的周期,并造成植物开花时间及下胚轴对光暗的响应能力异常。
基因表达谱
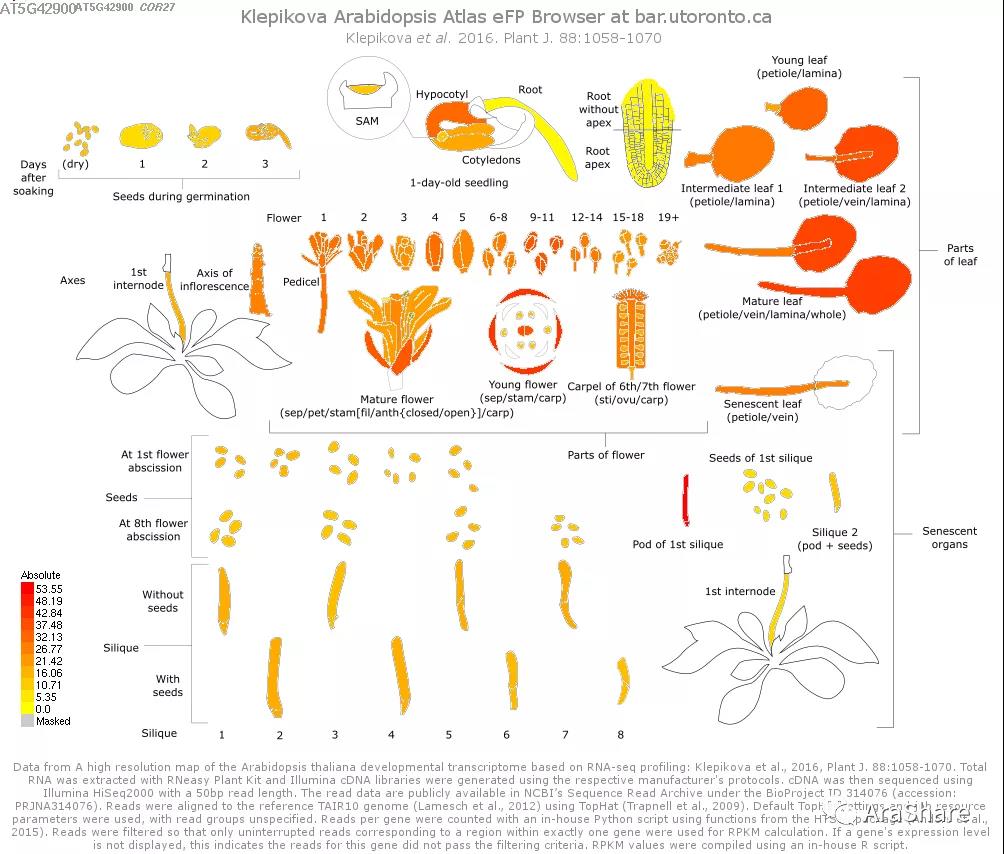
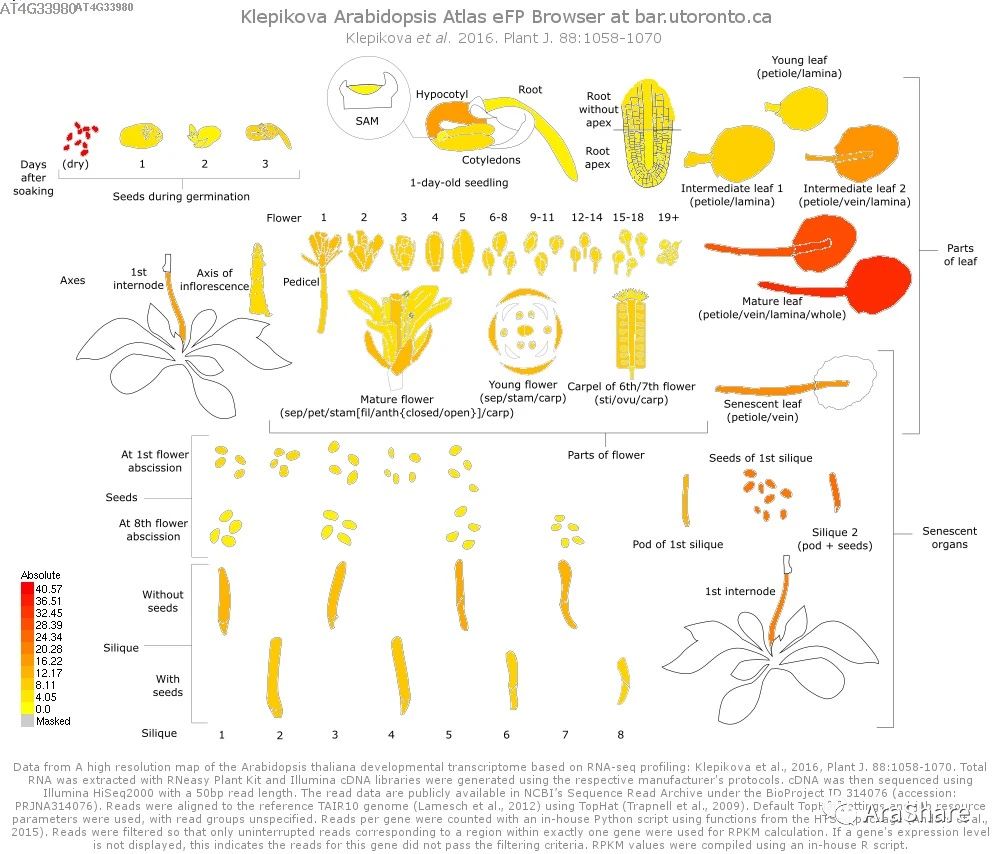
图1 拟南芥中COR27/28基因表达谱(Source: eFP Broswer from http://www.bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)
蛋白互作网络
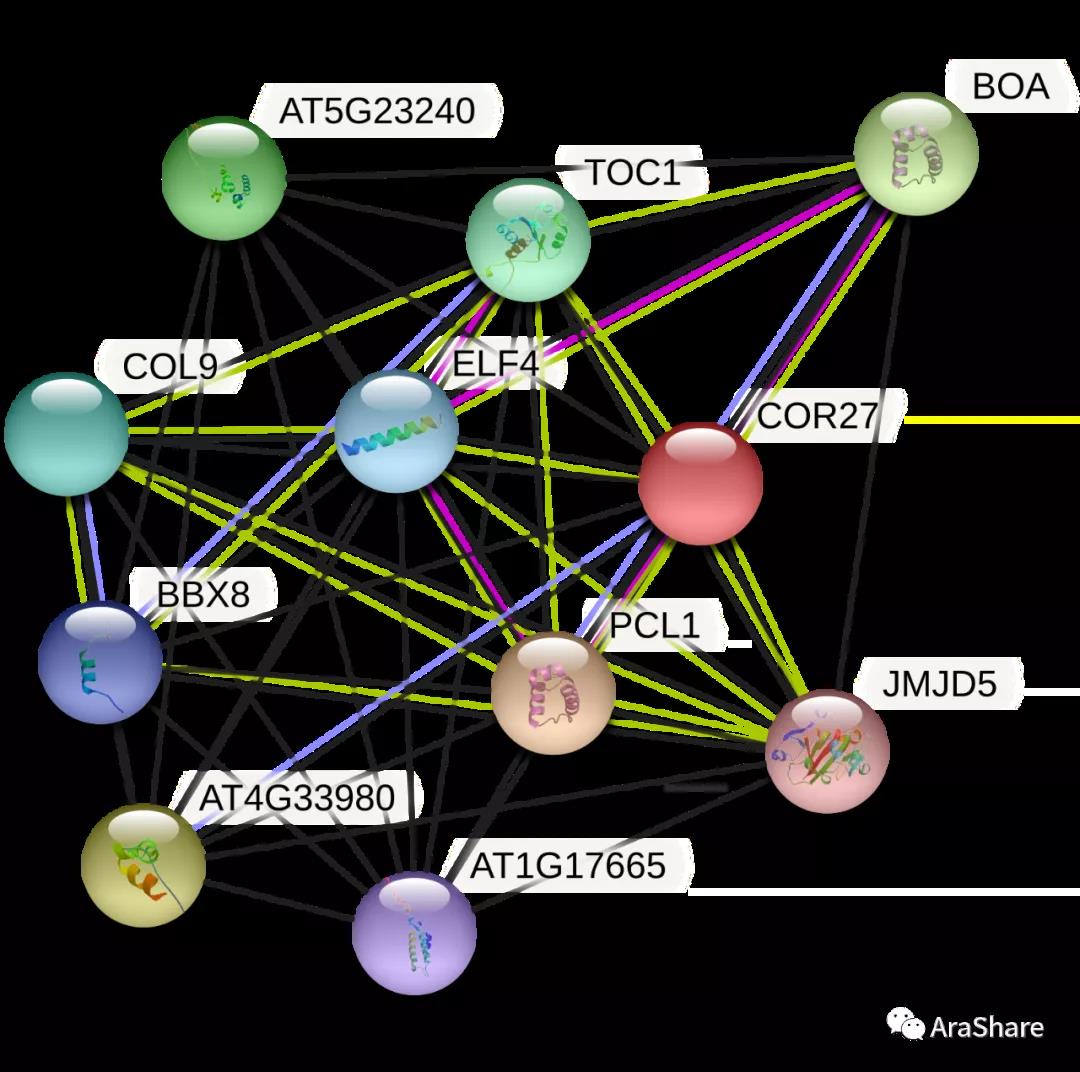
图2 预测COR27/28蛋白互作网络(Source: STRING from https://string-db.org/)
研究概况
起源
在低温研究领域,COR(Cold-regulated gene)类基因应该位列“元老”之列。在经典的低温信号通路中,低温信号在细胞内的传递涉及ICE1-CBFs-CORs的级联型转录信号通路。ICE1以及CBFs均为转录因子,而CORs作为下游信号如COR15A、COR78等所编码蛋白高度亲水,可以减缓低温胁迫对细胞生物膜的直接损伤。其它COR类蛋白,也具备抗氧化等功能,解除低温毒害的作用。COR27和COR28最早出现在低温引起的细胞转录组分析结果当中[1]。两者的表达能够快速受低温诱导,但在当时两者的基因结构以及蛋白的生化功能均属未知。因此研究人员仅以两者受低温诱导的特性以及表达蛋白的分子量对其命名。
新发现、新功能
对于转录型调控手段,分析启动子区域的调控元件通常是一种常见思路。09年植物低温信号研究的开拓者之一,美国Michigan State University的Michael F. Thomashow研究组即利用生物发光分析启动子活性的方式解析了COR27启动子构成以及其对低温的响应能力[2]。实验结果发现,在COR27启动子之上存在着一些EE(evening element),以及EEL(evening element like)元件,这些元件在一处较短的区域内呈串联的形式存在。删除或突变这些位点均会导致COR27启动子的活性丧失受低温诱导的特征。由于EE元件是一类生物钟调控元件。作者同时发现COR27的表达呈现节律振荡的特征,同时低温诱导COR27的表达也受生物钟门控(Gating),即一天当中的不同时间段COR27受低温诱导的响应能力也显著不同(见图3)。这篇文章预示了COR27除去逆境响应以外可能还具备正常生长发育的调节能力(因表达具备节律特征)。
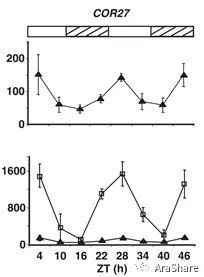
图3 COR27表达呈节律变化(上),受低温诱导的幅度与时间相关(下)[2]
之后关于COR27的研究沉寂了一段时间,而研究进展在2016年底出现了新的突破:我国上海植生所刘宏涛组[3]以及河北师范大学徐小冬组[4]在Plant cell以及JIPB上发表文章。分别从光温调控的方向以及生物钟调控的角度阐述了两者的功能。前者发现,COR27以及在基因结构上具备一定同源性的COR28,两者除去低温响应能力之外,还对蓝光产生响应(见图4)。两个基因的突变在正常生长状态下表现为开花延迟的表型,而在低温胁迫条件下则表现为低温耐受的表型。后者发现COR27或COR28突变后会出现生物钟核心元件振荡周期变长的表型。并通过EMSA、ChIP以及转录组分析,得到生物钟核心元件CCA1能够结合COR27/28的EE元件并调控两者的节律性表达。同时两者通过抑制生物钟核心元件TOC1、PRR5反馈调控生物钟核心系统。刘宏涛组的研究亮点在于重点解析了光温信号如何借由COR27/28来影响植物生物钟系统从而调控正常生长发育。而徐小冬组的亮点在于解析了COR27和COR28作为生物钟核心组分成员在夜间起抑制子的调控功能(见图5以及题图),并分析了正常生长或逆境状态下COR27和COR28节律表达性差异。两组的研究结果实质上明确COR27和COR28在植物生长发育与逆境抗性中起着“平衡器”般的重要作用。
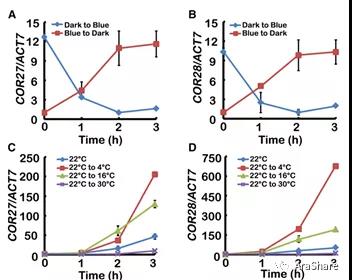
图4 COR27和COR28的表达响应蓝光与低温[3]

图5 COR27 COR28抑制基因的表达相位主要集中在夜间时段[4]
两者的研究需要进一步深入,但是如何进行突破?刘宏涛组给出了答案。原来在该组16年的文章中发现COR27/28在转录水平虽然受到蓝光抑制,但在蛋白水平两者则在暗条件下降解。因此暗示着两者在翻译或翻译后水平可能受到其它的调控元件所调控。以此为出发点,该组[5]以及北大邓兴旺组、南京农大许冬青组[6]在今年Plant Cell背靠背发表文章详细解析了这种调控机制并阐述了其重要的生理意义。两组的研究首先明确了在黑暗条件下,COR27/28可以和光信号通路中的核心抑制因子COP1互作后被降解。但这种分子水平的调控结果如何在生理水平体现?研究结果发现COR27和COR28在开花、低温耐受性之外还具备黑暗诱导下胚轴伸长的相关表型。结合已知的COP1-HY5作为经典的光形态调控通路,将COR27和COR28的作用置于其中进行解析似乎就变得理所当然。通过遗传学证据表明,COP1、COR27、HY5在光暗形态建成的下胚轴伸长调控中处于同一通路当中(见图6),生化分析揭示COR27可以和HY5互作抑制其转录活性。这时候你可以看到,COR27和COR28将“fine-tune”的作用体现的淋漓尽致,即在黑暗条件下,COR27/28被降解,解除对HY5的抑制作用,使暗形态建成条件下的下胚轴不至于“过分”伸长,而在光条件下COR27/28蛋白维持稳定,开始对HY5产生抑制,从而使光形态建成条件下的下胚轴又不至于“过分”变短。
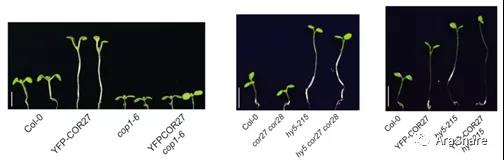
图6 COR27、COP1、HY5相关材料的下胚轴表型[5]
除此外,紧接着这两篇文章之后,9月上旬德国University of Freiburg的Andreas Hiltbrunner研究组发现[7]COR27/28不仅能够与COP1互作,且能够与光信号的上游元件phyA和phyB互作。由此可以看出COR27/28在光信号通路中还具备其它调控手段。
未来的研究方向
COR27/28为细胞核定位,这也是两者可以参与多条信号调控的基础。作为一个生长发育与逆境抗性的平衡器,如何解码不同的上游环境信号,并特意地将其向下游传递是细胞生物学研究中至关重要的环节。这在COR27/28的研究中还是较为欠缺的一部分。近年来研究火热的相分离可能提供了一个可能性,即胁迫性信号可能引起分子(COR27和COR28)在特定区域内聚合,以达到隔绝信号传递或起增强功能特异性的作用。
综合性信息
COR27和COR28的表达具备光温响应能力[1][3][4],且呈现节律性振荡表达特征[3][4]。两者在各组织中均有表达[3],但相对在莲座叶中表达水平较高[3]。两者启动区域2 kb区域内存在G-box、EE、EEL等元件,负责调控两者的低温响应能力以及节律振荡特征[2]。亚细胞水平上COR27和COR28为核定位[3][4]。两者蛋白质互作对象包括COP1[5][6][7]、HY5[5][6]、phyA[7]、phyB[7]。暂时未探明在蛋白质结构上两者存在已知结构域,但COR27和COR28含有“Val-Pro (VP)-peptide motif”,是COP1互作的识别位点[7],突变实验验证了该基序是COP1靶向COR27和COR28互作的基础[7]。COR27、COR28的突变影响了植物个体生物钟的正确调控以及对光温的响应能力[3][4]。在生理水平表现为开花时间[3][4]、下胚轴对光暗的响应[5][6][7]、植株对低温耐受能力[3][4]等方面出现异常。
突变体信息
cor27-1 (SAIL_772_H01) Knock down类型; cor27-2(SALK_042072) Knock down类型; cor28-1 (SAIL_279_D07) Knock down类型; cor28-2 (SALK_137155) Knock out类型。
以上T-DNA插入突变体Arashare中均有库存,欢迎您前往www.arashare.cn进行订购。
参考文献
[1] Fowler, S. & Thomashow, M. F., Arabidopsis Transcriptome Profiling Indicates That Multiple Regulatory Pathways Are Activated during Cold Acclimation in Addition to the CBF Cold Response Pathway, The Plant Cell, 2002
[2] Mikkelsen, M. & Thomashow, M., A role for circadian evening elements in cold-regulated gene expression in Arabidopsis, The Plant Journal, 2009
[3] Li, X.; Ma, D.; Lu, S. X.; Hu, X.; Huang, R.; Liang, T.; Xu, T.; Tobin, E.M. & Liu, H., Blue Light- and Low Temperature-Regulated COR27 and COR28 Play Roles in the Arabidopsis Circadian Clock, The Plant Cell, 2016
[4] Wang, P.; Cui, X.; Zhao, C.; Shi, L.; Zhang, G.; Sun, F.; Cao, X.; Yuan,L.; Xie, Q. & Xu, X., COR27 and COR28 encode nighttime repressorsintegrating Arabidopsis circadian clock and cold response,Journal of Integrative Plant Biology, 2016
[5] Li, X.; Liu, C.; Zhao, Z.; Ma, D.; Zhang, J.; Yang, Y.; Liu, Y. & Liu,H., COR27 and COR28 are Novel Regulators of the COP1-HY5 Regulatory Hub and Photomorphogenesis in Arabidopsis, The Plant Cell, 2020
[6] Zhu, W.; Zhou, H.; Lin, F.; Zhao, X.; Jiang, Y.; Xu, D. & Deng, X. W., COLD-REGULATED GENE 27 Integrates Signals from Light and the Circadian Clock to Promote Hypocotyl Growth in Arabidopsis, The Plant Cell, 2020
[7] Kahle, N.; Sheerin, D. J.; Fischbach, P.; Koch, L.-A.; Schwenk, P.; Lambert, D.; Rodriguez, R.; Kerner, K.; Hoecker, U.; Zurbriggen, M. D. & Hiltbrunner, A., COLD REGULATED 27 and 28 are targets of CONSTITUTIVELY PHOTOMORPHOGENIC 1 and negatively affect phytochrome B signalling, ThePlant Journal, 2020
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!