
 敬请关注公众号
敬请关注公众号
WUSCHEL介导的固有免疫: 植物干细胞抵御 病毒侵害的新机制
杜斐1 , 焦雨铃1, 2*
1中国科学院, 种子创新研究院, 遗传与发育生物学研究所, 国家植物基因研究中心(北京), 植物基因组学国家重点实验室, 北京 100101; 2中国科学院大学, 北京 100049
摘要
植物茎顶端分生组织干细胞是具有持续分化潜能的细胞团, 是植物体地上部所有组织和器官的来源。由于植物行固 着生长模式, 其无法通过移动来趋利避害, 因此保护植物干细胞免受病毒和其它病原体侵害对于植物正常生长发育至关重 要。尽管人们很早就观察到植物茎顶端干细胞区域与其它部位相比具有极强的抗病毒特性, 但很长时间以来对于植物干细 胞如何抵御病毒侵染却知之甚少。近日, 中国科学技术大学赵忠团队阐明了拟南芥(Arabidopsis thaliana)茎顶端干细胞通 过WUS蛋白介导的固有免疫反应抵御病毒侵害的机制。WUS能被黄瓜花叶病毒诱导表达, 并抑制病毒在茎尖中央区和周边 区积累。WUS通过直接抑制S-腺苷-L-甲硫氨酸依赖的甲基转移酶(SAM MTase)基因的转录, 影响rRNA的加工和核糖体的 稳定性, 使病毒蛋白质合成受阻, 从而阻止病毒的复制与传播。该研究揭示了植物体的一种保守且广谱抗病毒策略, 具有重 要的理论意义和应用价值。
关键词 拟南芥, 干细胞, WUS, MTase, rRNA, 蛋白质合成
植物茎顶端分生组织干细胞(stem cell, SC)是一 团长期维持低分化状态的细胞, 具有自我更新能力以 及分化成不同类型组织器官的潜能, 是植物体地上部 所有组织和器官的来源(Bäurle and Laux, 2003) (图 1A)。自然界中生长的植物体在整个生命周期中均会 受到多种病毒和其它病原微生物的侵害, 因此保护植 物茎顶端分生组织干细胞的完整性对于植物的正常 生长发育至关重要。人们很早就发现在植物病毒侵染 宿主的过程中, 病毒在宿主体内的分布不均一。植物 组织内的病毒含量随着与茎尖距离的缩短而减少 (Holmes, 1948)。在组织培养和再生研究中, 通过切 取植物茎尖作为外植体来繁育脱毒苗(virus-free plant)已经成为一项常规的技术手段(Wang et al., 2008)。人们由此推测, 与植物体其它部位相比, 植物 茎尖可能具有特殊的机制来抵御病毒侵染。然而, 在 很长一段时间内, 该机制始终未能得到阐明。
中国科学技术大学赵忠团队以模式植物拟南芥(Arabidopsis thaliana)为研究材料, 对茎顶端分生组 织干细胞的维持及分化机理进行了长期探索。近日, 该团队在植物干细胞抵御病毒侵染的机制研究方面 取得重要突破, 揭示了WUS (WUSCHEL)作为干细 胞的重要调控因子, 通过抑制病毒蛋白质合成, 介导 了干细胞对病毒的广谱抗性(Wu et al., 2020)。
黄瓜花叶病毒(CMV)是一类常见的RNA病毒, 具 有广泛的植物宿主, 是多种蔬菜和花卉的主要病原病 毒之一(Jacquemond, 2012)。赵忠团队以黄瓜花叶病 毒侵染拟南芥叶片作为实验系统, 追踪了病毒在茎尖 的扩散和分布模式。接种病毒9天后, 他们对病毒 RNA的原位杂交实验表明, 黄瓜花叶病毒大量积累 在茎的中柱区(shoot zone, SZ)和肋状区(rib zone, RZ), 中央区(central zone, CZ)、周边区(peripheral zone, PZ)和花原基(flower primodium, FP)中则无积 累(图1A)。需要特别指出的是, 黄瓜花叶病毒的分布 区域恰好位于WUS表达区域的下方。在clv3-7突变体中, 伴随着WUS表达区域上移至茎顶端分生组织的 第2层细胞(L2), 黄瓜花叶病毒的分布区也发生了上 移, 但依然位于WUS表达区域以下。由此他们得出两 种假设: (1) WUS表达区域可以形成一个屏障, 抑制 病毒的移动; (2) WUS蛋白本身可抑制病毒的积累。 为验证上述假设, 他们将黄瓜花叶病毒直接接种在具 有异常增大的茎顶端分生组织表型的mpS193/clv3-7 双突变体第1层干细胞(L1)或者组织中心(OC, L2), 发现病毒仍然积累在L2下方区域。这一结果表明, WUS的表达并不阻碍病毒的扩散, 但可抑制病毒在 WUS蛋白表达区域的积累。由于WUS蛋白的表达部 位仅包括组织中心和位于其上的干细胞, 如何解释周 边区和花原基中无病毒积累? 针对这一问题, 他们 进行了深入研究, 发现WUS蛋白的表达受到黄瓜花 叶病毒的强烈诱导, 病毒侵染可诱导WUS蛋白并在 周边区和花原基中异位积累, 从而扩大抗病毒区域。 组成型表达WUS可使整株植物获得对黄瓜花叶病毒 的抵抗力, 在干细胞中降解WUS蛋白则可促使病毒入侵中央区和周边区。上述结果表明, WUS可以介导 植物干细胞的抗病毒免疫反应, 且WUS蛋白的功能 对于抑制黄瓜花叶病毒的积累非常重要(Wu et al., 2020)。
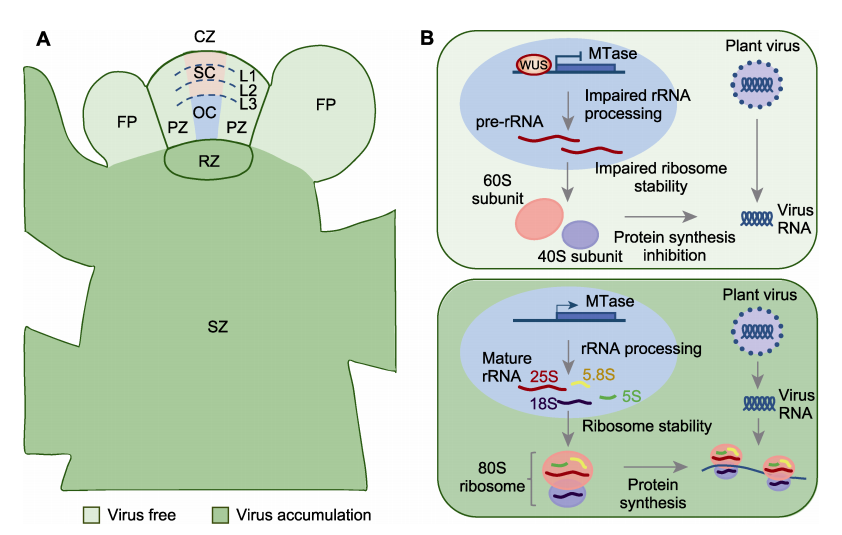
图1 WUS介导的茎尖干细胞抗病毒免疫机制
(A) 植物病毒侵染拟南芥叶片后在茎尖的分布模式; (B) 表达WUS和不表达WUS的细胞面对病毒侵染呈现不同的反应。L1─L3表示 3层细胞。CZ: 中央区; PZ: 周边区; RZ: 肋状区; SZ: 中柱区; FP: 花原基; SC: 干细胞; OC: 组织中心
随后, 他们分析了大量突变体, 结果表明WUS 介导的抗病毒免疫与RNA沉默、自噬和植物激素信号 通路之间相互独立。进一步研究发现, WUS可作为转 录抑制因子, 在本氏烟(Nicotiana benthamiana)叶片 中引起蛋白水平的转基因沉默, 且这种作用对蛋白酶 体抑制剂MG132处理不敏感, 提示WUS可能的作用 机制是抑制蛋白质合成, 而非加速蛋白质降解。为验 证WUS是否能够抑制黄瓜花叶病毒的蛋白质合成, 他们将WUS与GFP融合的病毒蛋白(2a、3a、2b和CP) 在烟草叶片中共表达, 发现GFP荧光信号与单独表 达病毒蛋白的对照组相比显著降低。在接种了黄瓜花 叶病毒的拟南芥中过表达WUS, 同样可显著降低病 毒蛋白在茎顶端分生组织的积累。为阐明WUS引起 的蛋白质合成受阻是否为转基因或者病毒特异, 他们检测了过表达WUS情况下拟南芥内源新生蛋白质水 平的变化。与蛋白质合成抑制剂CHX处理相似, WUS 的表达显著抑制了内源新生蛋白质的合成水平, 说明 WUS能够通过抑制细胞的蛋白质合成以及阻止病毒 的复制, 使植物体形成固有(或天然)免疫反应, 从而 保护茎尖免受病毒侵害(Wu et al., 2020)。
此外, 为探究WUS作为转录抑制因子调控蛋白 质合成的分子机制, 他们分析了过表达WUS植株在 接种和未接种黄瓜花叶病毒条件下的基因表达谱, 发 现11个参与蛋白质合成的基因表达量发生了改变; 其中, 包括7个编码S-腺苷-L-甲硫氨酸依赖的甲基转 移酶(SAM MTase)基因表达下调, 且内含的5个SAM MTase 编码基因受到 WUS 直接抑制 (Wu et al., 2020)。SAM MTase广泛存在于自然界, 参与多种生 物大分子(包括核酸、蛋白质和小分子代谢物)的甲基 化过程。由SAM MTase介导的甲基化可显著改变底 物的功能或生物学活性(Bennett et al., 2017)。在5个 受到WUS直接抑制的SAM MTase编码基因中, 仅有 NOP2A基因在茎顶端分生组织的周边区和花原基中 表达, 并在黄瓜花叶病毒侵染时表达量下降。与之前 的预测(NOP2A及其同源基因NOP2B可能负责25S rRNA在C2860位点的m5 C甲基化)一致, 在nop2a/ NOP2B RNAi植物中, RNA整体的m5 C甲基化水平和 包含m5 C甲基化修饰的25S rRNA丰度均显著降低, 证明NOP2A和NOP2B协同调控植物体内25S rRNA 的甲基化(Wu et al., 2020)。
rRNA甲基化对于rRNA的加工和稳定核糖体结 构非常重要。与野生型相比, rRNA的加工在nop2a和 其它4个SAM MTase编码基因的突变体中受到抑制, 导致rRNA中间体积累; 这与过表达WUS产生的表型 一致。多聚核糖体分析表明, 过表达WUS或突变SAM MTase编码基因可进一步导致80S和60S核糖体含量 下降。因此, WUS可能通过抑制SAM MTase编码基 因的转录影响核糖体的正常组装, 从而影响细胞内整 体的蛋白质合成。进一步研究显示, 过表达SAM MTase编码基因不仅可在烟草细胞中部分阻断WUS 过表达引起的蛋白水平的转基因沉默, 还可在拟南芥 茎顶端分生组织中部分抑制WUS介导的免疫反应, 增加黄瓜花叶病毒蛋白和RNA的积累。以上结果表 明, WUS对SAM MTase编码基因的转录抑制在植物 抗病毒反应中发挥了重要作用(图1B)。通过接种另外3种病毒, 他们又证明了WUS能够抑制多种病毒对拟 南芥茎顶端分生组织的侵害。因此, WUS介导的免疫 反应具有广谱的抗病毒效果(Wu et al., 2020)。
该研究具有重要的理论意义与应用价值。首先, 通过在干细胞区直接接种病毒, 他们发现WUS的表 达可抑制病毒的繁殖和积累。这一结果澄清了长期以 来的错误观点, 即植物茎尖不易受到病毒侵染是由于 缺少维管组织, 导致病毒无法有效移动。其次, 报道 了WUS除具有维持茎顶端分生组织干细胞活性外, 还参与了植物与病原微生物的互作过程, 回答了植物 茎尖何以有效抵御病毒侵害这一长期困扰科学家的 问题。再次, 鉴于多种植物的茎尖均可用于繁育脱毒 苗, 本研究揭示的WUS介导的抗病毒反应很可能是 一种植物体广泛采用的保守免疫策略。生产实践中, 可利用组成型或诱导表达WUS, 或抑制SAM MTase 表达的方法培育抗病毒作物, 减少抗病毒农药的施 用。此外, 研究结果还为后续工作提供了一些可深入 探索的问题。例如, WUS所在的WOX家族编码多个干 细胞特异转录因子来调控植物体不同部位的干细胞 活性(Aichinger et al., 2012), 其它WOX基因是否也 具有类似WUS的抗病毒功能? WUS如何避免自身的 蛋白质合成受到抑制? WUS介导的抗病毒免疫途径 与已知的抗病毒信号通路之间是否存在联系? 相信 这些有趣的问题在不久的将来均会得到一一解答。
参考文献
Aichinger E, Kornet N, Friedrich T, Laux T (2012). Plant stem cell niches. Annu Rev Plant Biol 63, 615–636.
Bäurle I, Laux T (2003). Apical meristems: the plant's fountain of youth. Bioessays 25, 961–970.
Bennett MR, Shepherd SA, Cronin VA, Micklefield J (2017). Recent advances in methyltransferase biocatalysis. Curr Opin Chem Biol 37, 97–106.
Holmes F (1948). Elimination of spotted wilt from a stock of dahlia. In: Report and Abstracts of the Second Annual Meeting of the Northeastern Division of the American Phytopathological Society. Phytopathology 38, 314.
Jacquemond M (2012). Cucumber mosaic virus. Adv Virus Res 84, 439–504.
Wang Q, Cuellar WJ, Rajamäki ML, Hirata Y, Valkonen JP (2008). Combined thermotherapy and cryotherapy for efficient virus eradication: relation of virus distribution, subcellular changes, cell survival and viral RNA degradation in shoot tips. Mol Plant Pathol 9, 237–250.
Wu H, Qu X, Dong Z, Luo L, Shao C, Forner J, Lohmann JU, Su M, Xu M, Liu X, Zhu L, Zeng J, Liu S, Tian Z,Zhao Z (2020). WUSCHEL triggers innate antiviral immunity in plant stem cells. Science Doi: 10.1126/Science. abb7360
本内容来源于网络,如有侵权请联系本网站删除,谢谢!