
 敬请关注公众号
敬请关注公众号
近年来,免疫检查点抑制剂在肿瘤免疫治疗方面取得了突破性进展[1]。程序性死亡配体1 (PD-L1) 在多种癌症中高表达,并通过与其在T细胞表面的受体PD-1相互作用来调节免疫逃避,导致T细胞衰竭。PD-1/PD-L1轴抑制剂可显著增强T细胞应答,并在多种晚期癌症中表现出显著的临床应答[1]。但临床试验数据显示,抗PD-1/PD-L1抗体等免疫治疗在实体瘤中的有效率低,仅20%左右。另外,长时间持续性的单一使用免疫检查点抑制剂治疗肿瘤并不能收到预期的疗效,甚至容易引发免疫耐受。因此,寻找行之有效的疗效预测标志和联合治疗是提高肿瘤免疫治疗效果和推进肿瘤精准免疫治疗的重要方法[2]。
烟酰胺腺嘌呤二核苷酸(NAD+)是生物体氧化还原反应中非常重要的辅酶,在包括代谢、衰老、细胞死亡、DNA修复和基因表达在内的各种生物学过程中起着至关重要的作用[3]。最近研究发现NAD+与肿瘤发生密切相关,NAD+会促进衰老细胞分泌促炎因子,刺激肿瘤细胞生长[4]。然而,NAD+代谢在免疫检查点调节和免疫逃避中的作用尚不清楚。
2020年11月9日,第二军医大学东方肝胆外科医院/国家肝癌科学中心王红阳院士/杨文研究员团队在Cell Metabolism上在线发表了题为 NAD+metabolism maintains inducible PD-L1 expression to drive tumor immune evasion 的研究论文,揭示了NAD+代谢通过调节免疫检查点PD-L1的表达,驱动肿瘤免疫逃逸的新机制,并提出了通过补充NAD+前体增强免疫治疗耐受肿瘤对抗PD-1/PD-L1抗体治疗敏感性的新策略。

(论文故事:NAD+调控肿瘤免疫存在两面性,好比京剧脸谱的红脸和白脸。白脸代表奸邪,预示NAD+促进肿瘤免疫逃逸的有害一面;红脸代表忠义,预示NAD+增强免疫治疗疗效的有利一面)
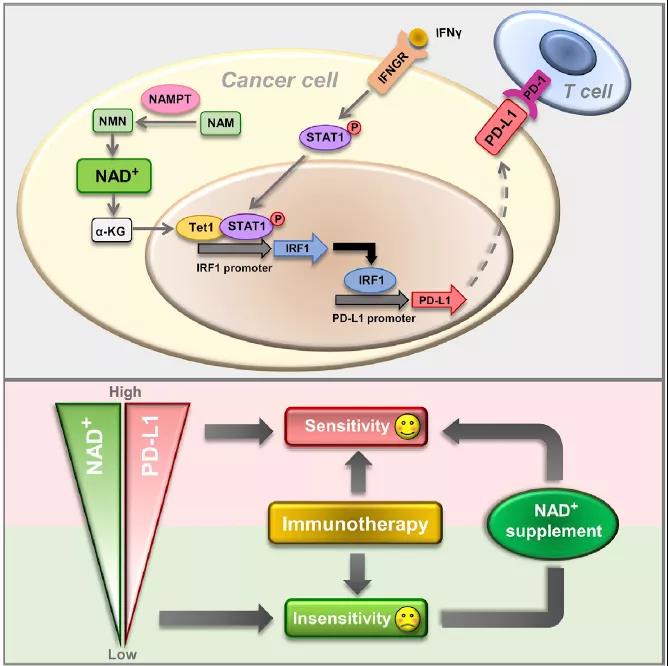
在该研究中,王红阳院士团队以NAD+合成途径中的关键限速酶NAMPT为切入点,发现了NAD+代谢可通过CD8+ T细胞依赖的方式驱动肿瘤免疫逃避。机制上,NAD+-α-酮戊二酸途径可通过激活TET1促进干扰素γ信号途径进而上调PD-L1的表达。更为重要的是,动物实验和临床数据分析发现,高表达NAMPT的肿瘤对抗PD-1/PD-L1抗体的治疗更敏感;对于抗PD-1/PD-L1抗体治疗耐受的肿瘤,通过补充NAD+前体(NMN)可显著增强治疗的敏感性。
该研究具有重要的临床意义,肿瘤NAMPT表达可能作为预测免疫治疗疗效的生物标志物,补充NAD+联合抗PD-1/PD-L1抗体的方案可为免疫治疗耐药的肿瘤提供了一种新的治疗策略。
东方肝胆外科医院/国家肝癌科学中心王红阳院士、杨文研究员为该论文共同通讯作者,研究实习员和研究生吕洪伟、吕桂帅、陈赐安为共同第一作者。
原文链接:https://doi.org/10.1016/j.cmet.2020.10.021
参考文献
[1] Ribas, A. & Wolchok, J.D. (2018). Cancer immunotherapy using checkpoint blockade. Science, 359:1350-1355.
[2] Gibney, G.T., Weiner, L.M., & Atkins, M.B. (2016). Predictive biomarkers or checkpoint inhibitor-based immunotherapy. Lancet oncology, 17: e542-e551
[3] Ryu, K. W., Nandu, T., Kim, J., Challa, S., DeBerardinis, R. J., & Kraus, W. L. (2018). Metabolic regulation of transcription through compartmentalized NAD+biosynthesis. Science, 360(6389), eaan5780.
[4] Nacarelli, T., Lau, L., Fukumoto, T., Zundell, J., Fatkhutdinov, N., Wu, S., ... & Noma, K. I. (2019). NAD+ metabolism governs the proinflammatory senescence-associated secretome. Nature cell biology, 21(3), 397.
本内容来源于网络,如有侵权请联系本网站删除,谢谢!