
 敬请关注公众号
敬请关注公众号
人可以从肉、蛋等食物中摄取胆固醇,但是在以碳水化合物为主要食物的情况下,人体胆固醇完全依赖自身合成。胆固醇合成需要消耗很多营养与能量,因此经过长期进化,哺乳动物只在进食后才明显上调胆固醇合成,而在饥饿状态下则抑制合成,但其中的调控机制一直不清楚。
2020年11月11日,武汉大学生命科学学院宋保亮课题组在Nature杂志上发表文章Feeding induces cholesterol biosynthesis via the mTORC1-USP20-HMGCR axis,揭示了进食诱导胆固醇合成的机制。

研究首先发现喂食小鼠高糖低脂食物后,肝脏中胆固醇合成途径限速酶HMGCR的蛋白量显著增加(图1 a)。通过体外生化实验,证明进食后肝细胞胞质中的去泛素化酶活性增强(图1b, c)。基于该线索,研究人员逐一克隆表达70多个去泛素化酶,最终筛选到USP20是HMGCR特异的去泛素化酶。
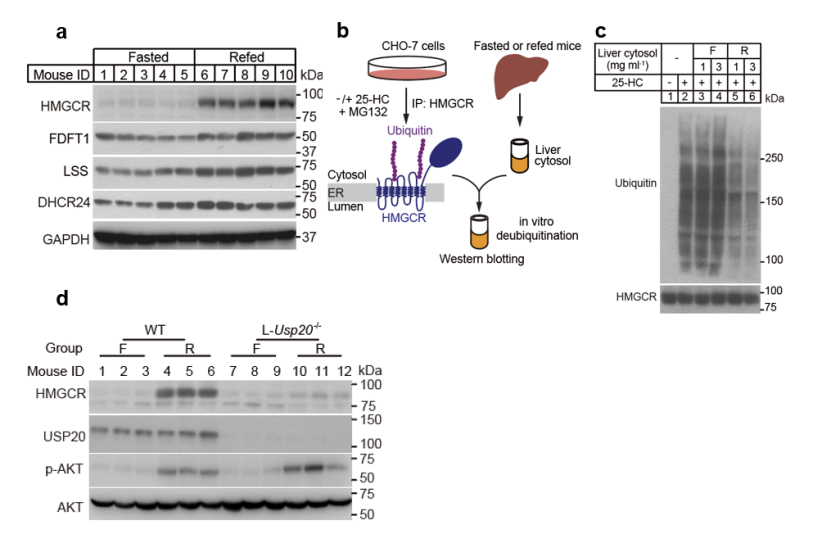
图1. 去泛素酶USP20介导进食诱导的HMGCR蛋白增加。
a, 小鼠饥饿或进食后肝脏中关键胆固醇合成酶的蛋白水平。Fasted: 饥饿组, Refed:再进食组;b, HMGCR体外去泛素化实验流程示意图;
c, 体外去泛素化实验分析HMGCR的泛素化水平;d, 检测野生型(WT)和肝脏特异性敲除USP20(L-Usp20-/-)小鼠在饥饿或进食后肝脏中相应蛋白水平的变化。
组织表达谱表明USP20在肝脏中高表达,在肝脏中敲除USP20基因后,进食诱导的HMGCR蛋白增加就不再发生(图1d),胆固醇从头合成的速率也大大降低。表明USP20介导的HMGCR去泛素化是进食诱导胆固醇合成的关键因素。
研究人员进一步发现,进食后血液中显著升高的葡萄糖和胰岛素协同激活mTORC1激酶,后者在S132和S134位点上磷酸化修饰USP20蛋白。该修饰并不影响USP20酶活性,但促使USP20结合HMGCR蛋白复合物,稳定HMGCR蛋白,上调胆固醇合成。在USP20(S132A/S134A)点突变小鼠(Usp20KI/KI)中,进食几乎不再诱导HMGCR蛋白增加(图2)。
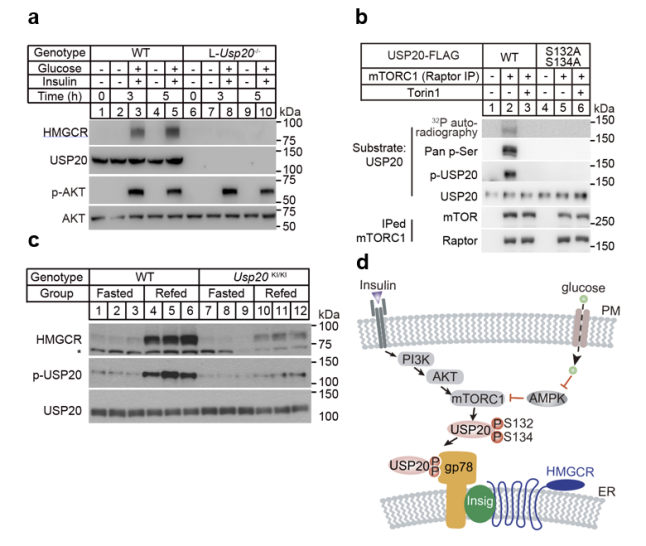
图2. 胰岛素和葡萄糖信号通过mTORC1磷酸化USP20。
a. 胰岛素和葡萄糖处理WT和L-Usp20-/-小鼠的原代肝细胞;b, 体外激酶表明mTORC1可直接磷酸化WT USP20,而不能磷酸化S132A&S134A突变的USP20;
c, 检测WT和Usp20KI/KI小鼠在饥饿或进食后肝脏蛋白水平变化;d, 信号通路模式图。
为了进一步阐明USP20在代谢性疾病中的功能,研究人员对WT和L-Usp20-/-小鼠用高糖高脂饲料喂养,相对于WT小鼠,L-Usp20-/-小鼠体重明显减轻(图3 a),体脂降低,肝脏中的脂肪堆积减少(图3 b),血液胆固醇水平显著下降(图3 c)。同时,基因敲除USP20导致小鼠产热增加,红外照相显示L-Usp20-/-小鼠有更高的体温(图3 d)。产热增加是由于代谢流改变,导致琥珀酸增多,后者诱导产热。研究人员还构建了持续稳定型HMGCR(K248R) knock-in小鼠,在此背景下敲除USP20则上述代谢表型消失,证明USP20缺失导致的代谢改变依赖HMGCR蛋白降解。
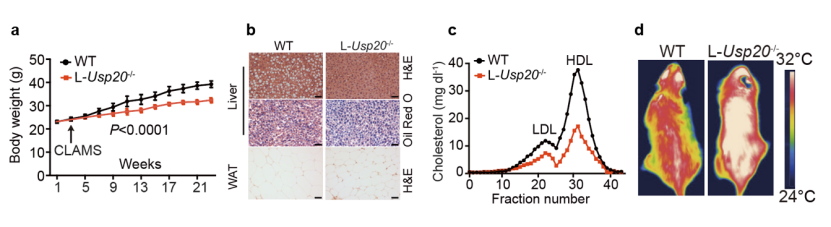
图3. USP20缺失可抑制代谢性疾病发生。
a, 小鼠体重变化;b, 肝脏和白色脂肪(WAT)组织切片染色;c, 脂蛋白胆固醇水平;d, 红外热像测量体表温度。
为探索USP20可否作为肥胖等代谢性疾病治疗的靶标,研究人员给予肥胖小鼠USP20抑制剂,发现该抑制剂能够显著减轻体重,降低血液胆固醇与甘油三脂水平及提高胰岛素敏感性(图4),抑制USP20后还引起琥珀酸增多,增加产热。这些代谢指标的改善均有助于治疗高胆固醇血症、肥胖、糖尿病等代谢疾病。另外,USP20抑制剂在L-Usp20-/-小鼠上没有效果,表明该化合物引起的代谢改善是通过抑制USP20而实现。
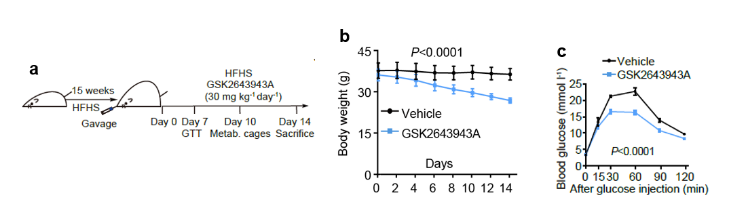
图4. USP20抑制剂可治疗代谢综合征。
a. USP20抑制剂治疗饮食诱导肥胖小鼠实验流程示意图。HFHS: 高糖高脂饲料,GSK2643943A:USP20抑制剂;b. 小鼠体重变化;c. 葡萄糖耐受实验(GTT)。
这篇论文针对饮食诱导胆固醇合成这一代谢领域的常见重要现象,基于巧妙设计的体外生化反应,发现新的调控因子USP20,并鉴定出新的功能性磷酸化修饰位点;在生理方面,发现进食后血液中升高的葡萄糖和胰岛素作为信号,激活mTORC1,后者磷酸化USP20而稳定HMGCR,上调胆固醇合成,从而将吸收的葡萄糖等营养物质转变为胆固醇;在病理和药物研发方面,长期高糖高脂饮食诱导USP20磷酸化增多,稳定HMGCR蛋白而升高胆固醇,是引起代谢性疾病的原因,相反抑制USP20可促使HMGCR降解,脂质合成减少,同时迫使琥珀酸生成增多,诱导产热。
总的来说,该论文从最初的生化发现,到个体生理病理,再到药靶验证,环环相扣,层层递进,非常值得一读。
芦小艺博士生、史熊杰副教授、胡傲博士生和王菊琼博士生为该论文共同第一作者,宋保亮教授为通讯作者。
宋保亮,教授,武汉大学生命科学院院长。主要研究胆固醇代谢调控与代谢性疾病。他在细胞内胆固醇运输、人体胆固醇代谢稳态调控和胆固醇代谢新功能等方面取得了系统性、有重要国际影响的原创成果:1)阐明一个胆固醇合成的负反馈调控通路与人体胆固醇吸收的分子通路,奠定了当前学术界对这两个代谢途径的认识;2)发现由过氧化物酶体膜接触介导的胆固醇运输新途径,证明膜接触是主要的运输方式,并决定脂质在细胞内的精确分布;3)鉴定蛋白质胆固醇共价修饰新类型,颠覆了长期认为Hedgehog 是唯一胆固醇修饰蛋白的认识,揭示胆固醇可作为共价配体调控信号转导和发育。相关成果以通讯(含共同通讯)作者在Nature、Science、Cell、Nat Med、Cell Metab、Mol Cell、Nat Cell Biol、Nat Metab等期刊发表,成果被选入十余部英文教材与专著,受邀在Nature Reviews Molecular Cell Biology撰写胆固醇代谢大综述。担任中国细胞生物学学会副理事长、基金委重大研究计划“糖脂代谢的时空网络调控”专家组组长等。
原文链接:https://www.nature.com/articles/s41586-020-2928-y
本内容来源于网络,如有侵权请联系本网站删除,谢谢!