
 敬请关注公众号
敬请关注公众号

1.基因信息
Locus编号:AT1G65480
常用名称全称:FLOWERING LOCUS T, FT
其它名称:REDUCED STEM BRANCHING 8, RSB8
2.基因功能
FT是拟南芥开花调控途径中光信号途径和春化途径的重要节点基因,与分生组织特征基因LFY共同促进开花。FT的mRNA和蛋白均可以从叶片转运到顶端,在顶端分生组织中,FT蛋白与FLOWERING LOCUS D (FD)、14-3-3s蛋白结合形成成花素激活复合体(Florigen Activation Complex, FAC)诱导开花。
3. 突变体信息
目前研究论文中已有的突变体表型多表现为晚花,拟南芥叶片受影响。

在国内拟南芥突变体共享中心AraShare中有一个FT突变体,NASCode为N866592,可通过www.arashare.cn征订。
4. 基因表达谱
FT的mRNA在叶片中合成,研究表明其mRNA和蛋白均可以从叶片转运至顶端,促进成花转变。
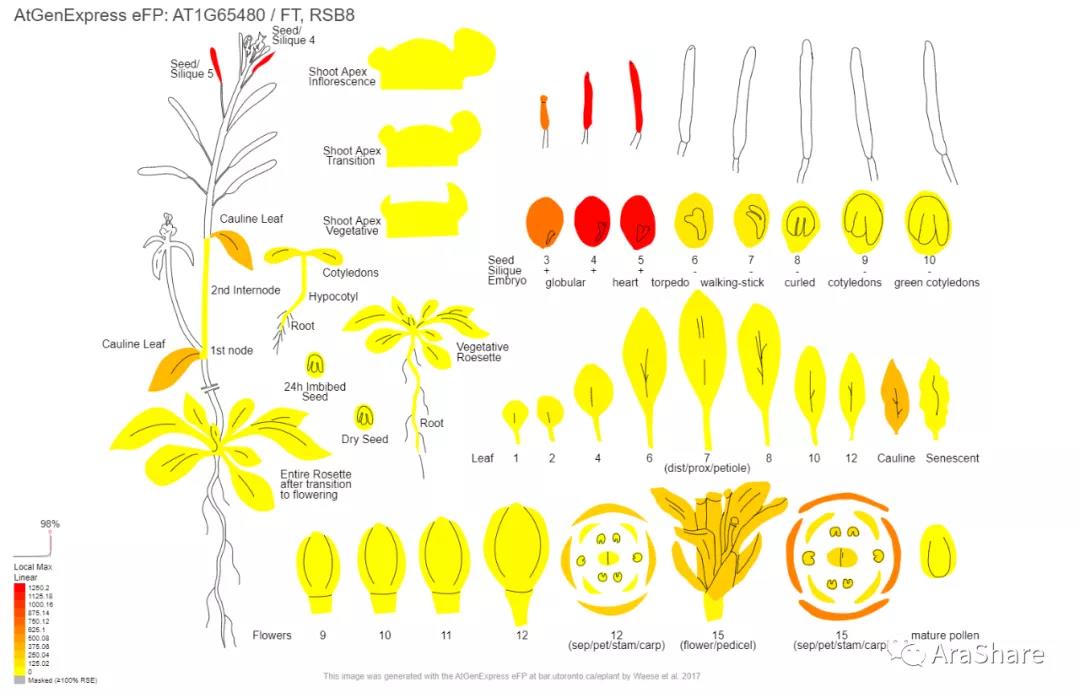
图1.拟南芥中FT基因表达谱(来自eFP browser)
5. 研究概况
开花是植物从营养生长转变到生殖生长的关键的生命历程,受到光信号途径、春化途径、激素途径等多种内源及外源因素的调控。FT同时参与光信号途径与春化途径促进拟南芥开花,是重要的“成花素”信号。
(1)FT在科学界的“发迹史”
对FT的研究可以追溯至上世纪六十年代人们对拟南芥晚花突变体的筛选[1],直至1983年Van der Veen课题组通过连锁图谱分析发现这些晚花突变体中包含ft突变体[2]。对FT功能的深入研究始于19世纪90年代,1999年,Weigel课题组通过激活标记法(Activation Tagging)分离出FT,发现FT能够与顶端分生组织特征基因LEAFY(LFY)共同促进拟南芥开花,并且二者同时受到CONSTANS(CO)的调控。有趣的是,该研究还发现FT与其同源基因TERMINAL FLOWER1(TFL1)在调控拟南芥开花过程中发生拮抗作用(图2)[3]。同期,Araki课题组对FT的功能研究得到与Weigel课题组类似的研究结果,并且在该论文的最后,作者针对FT行使功能的方式提出一个大胆的猜测,即FT是否可以作为一个可以移动的信号呢[4]?该猜测在随后的研究中得到了证实:2005年,Nilsson课题组发现FT的mRNA在叶片中合成之后可以转运到顶端,并且激活下游开花基因的表达,即FT的mRNA是从叶片到顶端的一个重要“成花素”信号[5]。两年后,Coupland课题组和Weigel课题组先后发现FT蛋白可以作为一个远程信号通过韧皮部从叶片运送的顶端促进拟南芥开花[6][7]。在当时,该发现奠定了FT在植物中作为唯一一个已知的可以作为长程信号蛋白的重要地位。

图2.19天大小的ft突变体及转基因植株表型
上图从左到右分别为:野生型Col-0、35S::FT(箭头所示为末端的花)、短日照条件下的35S::FT、35S::FT 35S::TFL1、35S::FT tfl1-1(箭头所示为末端的花形成的果荚)、tfl1-1。
图片引自Weigel课题组研究结果[3]。
(2)揭开FT与FTL1的“复杂关系”
上文提到FT与其同源基因TFL1在开花中行使拮抗作用,因此TFL1有“抗花素”之称,实则二者均属于FT/TFL基因家族,拟南芥中包含6个FT/TFL基因家族成员(FT、TFL1、TWIN SISTER OF FT (TSF),BROTHER OF FT AND TFL1 (BFT),ARABIDOPSIS THALIANACENTRORADIALIS HOMOLOG (ATC) 和MOTHER OF FT AND TFL1 (MFT)),可分为四个亚家族:FT-like(FT和TSF)、TFL1-like(TFL1和ATC)、MFT-like(MFT)以及BFT-like(BFT)。FT与TFL1的CDS序列一致性为59%,蛋白序列一致性为55%,二者的相互拮抗可能是因为TFL1与FT竞争性地结合FD,阻碍FT-FD复合物的形成,从而无法激活下游开花相关基因的表达,进而抑制开花,至于其具体机制还有待进一步研究[8]。
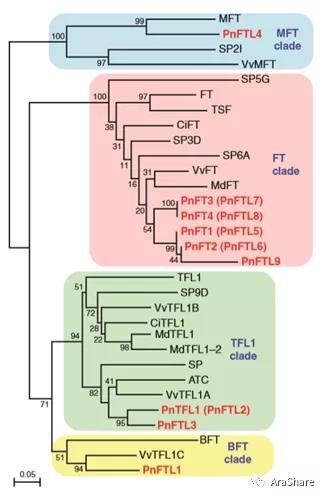
图3.不同物种中FT/TFL基因家族进化树(引自Tomohiro Igasaki等[9])

图4.FT/TFL1的CDS与蛋白序列的多序列比对
(3)”多面手”FT
随着对FT研究的深入,其开花以外的其它功能也被挖掘出来,涉及众多与物种繁衍有关的性状。比如FT通过响应蓝光参与调节气孔开关[10]、通过感受光照周期影响侧根发育[11]。此外,除了响应光信号,FT还可以参与水杨酸信号调节开花[12]。
6. 基因网络
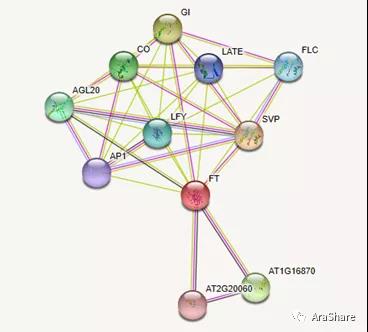

图5.STRING预测FT蛋白互作网络
FT在拟南芥中的主要功能是促进开花,STING预测的与FT有互作的蛋白网络中多数蛋白处于开花通路中。但是线粒体28S核糖体蛋白(AT1G16870)和核糖体蛋白L4/L1家族(AT2G20060)与FT也有互作,暗示FT可能与核糖体蛋白共同行使功能。
7. 其他物种研究情况简介
FT的功能在不同的开花植物中具有一定的保守性,比如在多年生木本植物、豆科植物、杜鹃花科等中均可以促进开花。值得一提的是FT在其它物种中的同源基因进化出了不同的生物学功能:在水稻中诱导FT同源基因Hd3a的表达可以促进水稻在短日照下提前抽穗[13];土豆中的FT-like基因StSP6A可以响应光周期诱导块茎的形成[14]。这些研究表明FT作为一个可移动的信号,它的功能不仅仅局限于控制开花,可能还控制其它分生组织相关的转变。土豆中的另一个重要研究结果表明,StSP6A与StSWEET11可以直接相互作用促进蔗糖的共质体运输,即调节土豆的库源分配,建立起糖的运输储存和光周期途径之间的紧密联系[15]。
8. 展望
FT从最初发现作为开花促进子至今已有三十余载,总体上,人们对于FT在调节植物开花方面的研究已经比较深入,但是仍然有很多问题需要解决:
如FT在叶片中合成后是受到何种信号诱导转移至顶端的?
FT与TFL1拮抗的具体分子机制是什么?
FT在其它物种中的功能还有待进一步挖掘:FT除了调控块茎的发育,是否在储藏根植物中也发挥重要作用?
FT除了参与蔗糖转运,是否还参与其它糖类代谢过程影响植物的库源分配?
这些问题的回答将为理解块根/块茎类植物进化的分子机制、植物感受光周期与能量储存之间的关系等重要科学问题提供参考。
参考文献:
[1] Heynh HAS Hussein. Genetic analysis of mutagen-induced flowering time variation in Arabidopsis thaliana[D]. 1968.
[2] Koornneef M, Hanhart C J,Van Der Veen J H. A genetic and physiological analysis of late floweringmutants in Arabidopsis thaliana[J]. Mol Gen Genet, 1991, 229(1): 57-66.
[3] Igor Kardailsky, Vipula K. Shukla, Ji Hoon Ahn, Detlef Weigel. Activation tagging of the floral inducer FT[J]. Science,1999, 286(5446): 1962-1965.
[4] Y Kobayashi, H Kaya, K Goto, M Iwabuchi, T Araki. A pair of relaed genes with antagonistic roles in mediating flowering signals[J]. Science, 1999, 286(5446): 1960-1962.
[5] Tao Huang, Henrik Bo ¨hlenius, Sven Eriksson, Franc¸ois Parcy, Ove Nison. The mRNA of the Arabidopsis Gene FT Moves from Leaf to Shoot Apex and Induces Flowering[J]. Science, 2005, 309(5741): 1694-1696.
[6] Laurent Corbesier, Coral Vincent, Seonghoe Jang, George Coupland. FT Protein Movement Contributes to Long-Distance Signaling in Floral Induction of Arabidopsis[J]. Science, 2007, 316(5827): 1030-1033.
[7] Jaeger K E, Wigge P A. FTprotein acts as a long-range signal in Arabidopsis[J]. Curr Biol, 2007, 17(12):1050-1054.
[8] Shigeru Hanano, Koji Goto. Arabidopsis TERMINAL FLOWER1 Is Involved in the Regulation of Flowering Time and Inflorescence Development through Transcriptional Repression[J]. The plant cell, 2011, 23, 3172-3184.
[9] Igasaki T, Watanabe Y,Nishiguchi M, et al. The FLOWERING LOCUS T/TERMINAL FLOWER 1 family in Lombardypoplar[J]. Plant Cell Physiol, 2008, 49(3): 291-300.
[10] Kinoshita T, Ono N,Hayashi Y, et al. FLOWERING LOCUS T regulates stomatal opening[J]. Curr Biol, 2011, 21(14): 1232-1238.
[11] Hiraoka K, Yamaguchi A,Abe M, et al. The Florigen Genes FT and TSF Modulate Lateral Shoot Outgrowth inArabidopsis thaliana[J]. Plant and Cell Physiology, 2013, 54(3): 352-368.
[12] Martinez C, Pons E, PratsG, et al. Salicylic acid regulates flowering time and links defence responsesand reproductive development[J]. Plant J, 2004, 37(2): 209-217.
[13] Shoko Kojima, Yuji Takahashi, Yasushi Kobayashi, Masahiro Yano. Hd3a, a Rice Ortholog of the Arabidopsis FT Gene, Promotes Transition to Flowering Downstream of Hd1 under Short-Day Conditions[J]. Plant Cell Physiol , 2002, 43(10), 1096-1105.
[14] Navarro C, Abelenda J A,Cruz-Oro E, et al. Control of flowering and storage organ formation in potatoby FLOWERING LOCUS T[J]. Nature, 2011, 478(7367): 119-122.
[15] Abelenda J A, Bergonzi S, Oortwijn M, et al. Source-Sink RegulationIs Mediated by Interaction of an FT Homolog with a SWEET Protein in Potato[J].Curr Biol, 2019, 29(7): 1178-1186 e1176.
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!