
 敬请关注公众号
敬请关注公众号
植物激素在植物的生长发育过程中发挥着重要作用。植物激素生长素主要作用是促进植物的生长。植物激素水杨酸(SA)在植物抗病抗逆过程中发挥着重要作用。而植物激素之间也是具有相互作用的。在病原体感染期间,拟南芥GH3.5作为SA和生长素的双功能调节剂发挥作用。
1.基因信息
Locus:AT4G27260
Name: GH3.5
Other Name: WES1
2.基因背景介绍
生长素早期响应基因(Primary-response genes)主要分为三类:AUX/IAA、GH3、SAUR。三个家族的编码基因在生长素的处理下能够被迅速的激活转录。目前,GH3家族在拟南芥中一共鉴定到20名成员。通过对其功能研究显示,GH3家族参与了拟南芥的生长发育调控,逆境响应等等。在GH3家族中,GH3.5除了能被生长素激活之外,还能被SA激活[1,2]。这是该家族唯一具有此活性的成员。
3.突变体信息
GH3.5又称作WES1。过表达WES1的wes1-D的植株表现出植株矮小,植物器官较小,叶子卷曲,顶端优势降低的表型。而敲除的wes1突变体除了具有稍大叶片之外,并没有特别明显的表型(图1)[3]。在黑暗培养条件下,wes1-D的下胚轴和wes1突变体的下胚轴长度相似;而在光照培养条件下,wes1-D下胚轴明显短于对照组,而wes1下胚轴则长于对照组(图2)[4]。
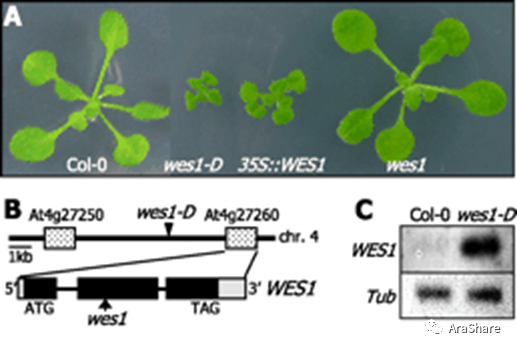
图1. wes1-D的表型和WES1基因的表达模式[3]
(Fig.1 Phenotype ofwes1-D and WES1 expression patterns.[3])
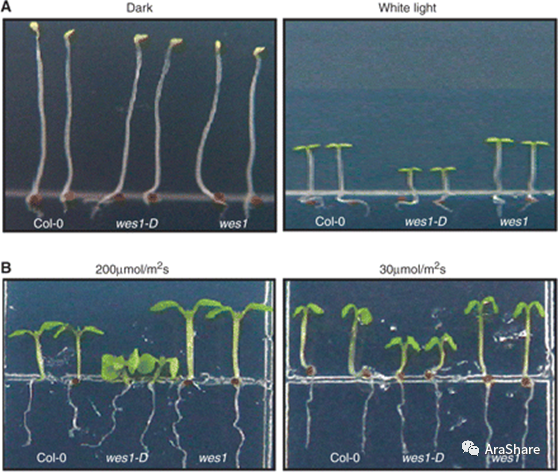
图2. 不同光波对wes1-D和wes1下胚轴生长的影响[4]
(Fig.2 Effects ofdifferent light wavelengths on hypocotyl growth of wes1-D and wes1[4])
4.基因表达图谱
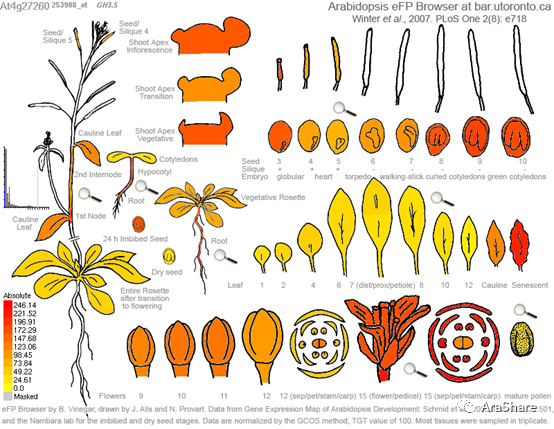
图3. GH3.5基因表达图谱(引自 eFP browser)
(Fig.3 Gene expression pattern of GH3.5)
5.研究概况
2007年,韩国首尔大学化学系的Chung-Mo Park教授筛选到一个严重矮化的突变体。该突变体表现为植株矮小,植物器官较小的特点,根据韩语中“矮小身材”将其命名为wes1-D。wes1-D还表现出小卷曲叶子,顶端优势降低和稍早开花的表型,该表型与生长素相关突变axr2-1表型非常相似。这就暗示了该基因与生长素的特殊关系[3]。随后,基于RT-PCR及Southern印迹杂交分析,显示At4g27260转录本的水平在野生型植物中极低,但在wes1-D中却以很高的水平存在,即表明该基因的过量表达是wes1-D产生异常表型的分子原因。通过对该基因的T-DNA插入突变体wes1进行表型观察,发现wes1与野生型植物相比较,除了具有稍大叶片之外,并没有特别明显的区别。接下来,作者证实了wes1-D表型与生长素的作用有关。同年,该实验室通过对wes1-D和wes1突变体下胚轴表型进行观察发现,GH3.5能够通过介导细胞色素B调节光信号,进而影响下胚轴的生长[4]。2012年,瑞典科学家Catherine Bellini研究组报道了,GH3.3,GH3.5,GH3.6三个基因是拟南芥下胚轴微调不定根起始所必须的关键基因[5]。
以此同时,中科院的何祖华教授实验室也揭示了GH3.5在植物和病原菌互作过程中的调节机制。早至2007年,何祖华教授实验室已报道,GH3.5对于植物来说是一把双刃剑,在SA介导的抗病性和生长素诱导的植物感病性反应中扮演了双功能调节的角色[6]。除此之外,体外实验显示,GH3.5能够腺苷酰化生长素和SA的活性。那么,GH3.5对于其底物的选择是怎样的呢?2017年,Mary C. Wildermuth教授实验室通过动力学研究得出结论。结果显示GH3.5催化天冬氨酸与生长素和SA相结合,并且其天冬氨酸的浓度决定了GH3.5对生长素和SA的偏好性(图4)[7]。
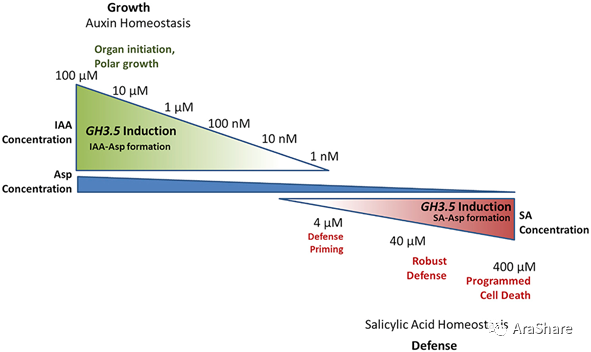
图4 GH3.5作为防御和生长媒介的功能模型[7]
(Fig.4 Model for GH3.5 function as a mediator of growth vs defense[7])
6.蛋白调控网络
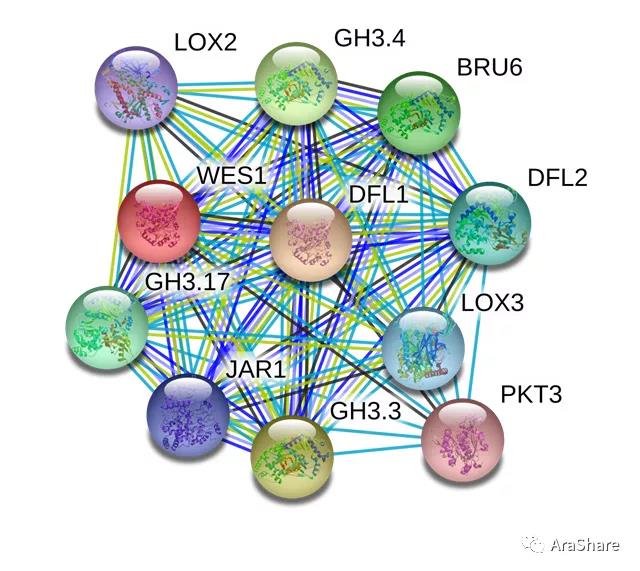
图5 拟南芥中GH3.5蛋白互作网络预测(来自STRING)
(Fig.5 Protein interaction network of GH3.5)
如图5所示,GH3.5蛋白互作网络已得到较好的剖析。GH3.5与GH家族多名成员有互作;植物脂氧合酶2和3(LOX2,LOX3)可能参与植物生长发育、抗虫害、衰老或损伤等多种生理反应。可以推测GH3.5与其存在互作,在植物的抗病过程中共同发挥作用。
7.其他物种研究情况简介
在水稻的GH3.5的相关研究发现,将该基因异源表达于大肠杆菌中,能够催化植物激素茉莉酸(JA)与异亮氨酸的结合。新疆野苹果GH3.5基因在根系发育及植物抗旱应答过程中发挥作用。
8.展望
感谢一代又一代的科学家们,已经清晰揭示了拟南芥GH3.5在植物抗病过程中的重要性。但是科学是不断进步的,仍存在许多问题需要探讨,比如:GH3.5蛋白是否还与其他植物激素存在相互作用,如ABA及GA等;在其他物种中GH3.5的功能也需要得到进一步的研究。相信随着生命科学的发展,我们将对GH3.5以及整个GH3家族所介导的信号通路有更为深刻的认识。
参考文献:
[1] Chen Y, Shen H, Wang M, et al (2013) Salicyloyl-aspartate synthesizedby the acetyl-amido synthetase GH3.5 is a potential activator of plant immunityin Arabidopsis. Acta Biochim Biophys Sin (Shanghai) 45: 827-836.
[2] Westfall CS, Sherp AM, Zubieta C, et al (2016) ArabidopsisthalianaGH3.5 acyl acid amido synthetase mediates metabolic crosstalk inauxin and salicylic acid homeostasis. Proc Natl Acad Sci U S A 113: 13917-13922.
[3] Park J-E, Park J-Y, Kim Y-S, et al (2007) GH3-mediated auxin homeostasis linksgrowth regulation with stress adaptation response in Arabidopsis. J BiolChem 282: 10036-10046.
[4] ParkJ-E, Seo PJ, Lee A-K, et al (2007) An Arabidopsis GH3Gene,Encoding an Auxin-Conjugating Enzyme, Mediates Phytochrome B-Regulated LightSignals in Hypocotyl Growth. Plant Cell Physiol 48: 1236-1241.
[5] Gutierrez L, Mongelard G, Flokova K, et al (2012) AuxinControls Arabidopsis Adventitious Root Initiation by Regulating Jasmonic AcidHomeostasis. Plant Cell 24: 2515-2527.
[6] Zhang Z, Li Q, Li Z, et al (2007) DualRegulation Role of GH3.5 in Salicylic Acid and Auxin Signaling duringArabidopsis-Pseudomonas syringae Interaction. Plant Physiol 145: 450-464.
[7] Mackelprang R, Okrent RA, Wildermuth MC (2017) Preference ofArabidopsis thalianaGH3.5 acyl amido synthetase for growth versus defense hormone acyl substratesis dictated by concentration of amino acid substrate aspartate. Phytochemistry 143:19-28.
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!