
 敬请关注公众号
敬请关注公众号
维管束系统贯穿整个植物体。维管细胞的发育起始于胚胎形成时期,随后维管细胞增殖逐步形成维管组织,这一过程遵循特定的细胞命运。近年来结合分子遗传学研究和数学建模模拟方法让我们更好的认识了维管束系统早期发育的分子机理和激素调控网络。早期的维管束发育受到了bHLH家族转录因子LONESOME HIGHWAY(LHW)与TARGETOF MONOPTEROS5(TMO5)的严格调控。LHW-TMO5转录因子家族紧密地参与植物激素的合成和信号网络,进一步介导了维管束系统的命运决定。
1.基因信息
Locus: AT3G25710
Name:TARGET OF MONOPTEROS5, TMO5
Other Name: AIG5, BHLH32(BASIC HELIX-LOOP-HELIX 32)
2.基因背景介绍
早期建立的根维管组织与生长,分化模式和激素信号通路紧密相连。尽管植物激素生长素和细胞分裂素早就被认为是关键的参与者,研究工作者们也是直到最近才开始了解这些信号通路如何相互作用以在分子水平上控制维管组织发育。生长素下游重要的相应因子MONOPTEROS(也被称为ARF5)对于维管束发育的起始十分重要[1]。ARF5的缺失突变体表现出,在维管发育过程中,原维管初始细胞分裂的缺失。而ARF5转录因子下游调控的基因中,TMO5表达于最早出现的两个原维管束细胞中,而这两个原维管束细胞由于距离子叶最近也是接受到生长素最多的细胞。TMO5与它的同源蛋白TMO5L1与另一个bHLH家族转录因子LHW形成异源二聚体进一步参与了下游基因表达的调控。功能缺失TMO5或者LHW基因会导致在维管组织形成过程中平周细胞分裂次数的减少。因此,在早期胚胎发育的早期维管束系统建立过程中,TMO5/LHW介导了MONOPTEROS依赖的平周细胞分裂活动[2-4]。
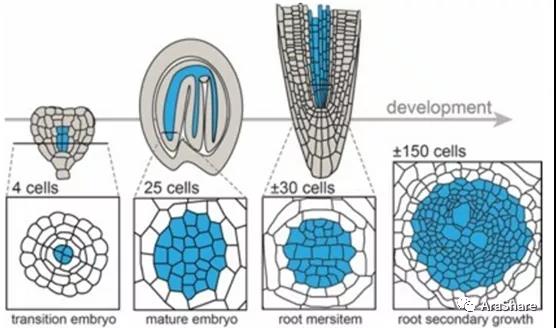
图1.维管系统的发育过程
两个原维管早期细胞最先出现于三角形阶段的胚。随后这些细胞由于接收到生长素信号开始进行平周分裂,这四个新出现在胚胎中间的细胞就是维管原始细胞,随后维管原始细胞会开始进一步平周分裂,并且逐步分化形成维管系统。这一过程中,细胞分裂素十分重要。
3.突变体信息
单lhw突变体和tmo5 t5l1双突变体中,拟南芥的根中维管细胞数目减少,而多重突变体中,维管细胞数目会更进一步的减少。相反,过表达TMO5,特别是同时过表达LHW和TMO5引起维管细胞的过度增殖[2-4]。不同于LHW基因是通过遗传筛鉴定得到的,TMO5从名字可以认识到其实是反向遗传学鉴定到的一类转录因子。在2010年,研究者通过筛选在早期维管束建成过程中受生长素响应因子调控的下游基因中重要的基因,鉴定到了一类靶向目标基因,被命名为TMO1-8[4]。在遗传上,pMP::TMO5可以较好的回补mp-S319无根的表型,因此TMO5是作用于MP转录因子下游,指导根部维管束发育的重要因子。
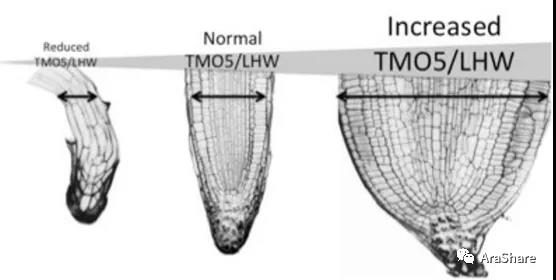
图2.TMO5/LHW的表达量影响根部发育
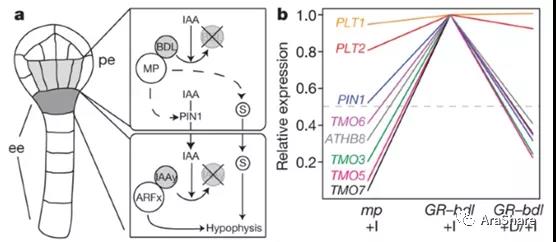
图3.通过分析表达水平鉴定到TMO基因
使用地塞米松诱导体系,作者构建了条件性诱导降解MP的转基因植物,来模拟不同情况下的基因表达模式。+I表示加入IAA来诱导MP降解,+D表示加入地塞米松诱导BDL入核。其中BDL是生长素诱导的降解子。
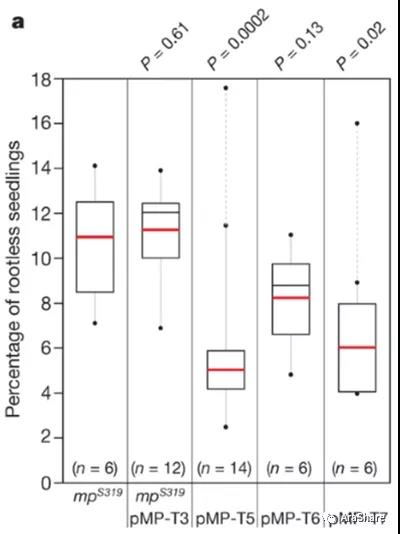
图4.pMP::TMO5可以较好的回补mp-S319无根的表型
4.基因表达图谱
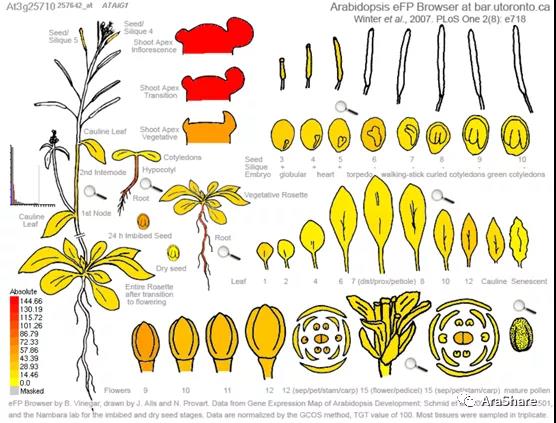
图5.TMO5基因表达图谱(引自eFPbrowser)
5.研究概况
2010年,来自根特大学的Dolf Weijers教授课题组为了寻找胚胎发育过程中胚柄发育决定的信号分子,通过仔细分析芯片表达数据鉴定到了MP下游调控的数个基因参与了从胚到胚柄形成的细胞命运决定过程。其中TMO5是一类较少被报道的bHLH家族的转录因子,其表达在很早期的原维管初始细胞中就有表达,而且遗传上也被证明参与到了MP决定的早期细胞平周分裂,因此决定了维管系统的发育。
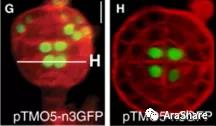
图6.TMO5的定位
随后在2014年,根特大学的Dolf Weijers教授课题组在Science上发表文章进一步发现TMO5与LHW形成的异源二聚体TMO5/LHW能够直接靶向并诱导LOG4和LOG3的表达,从而控制细胞的增殖。LOG4基因及其LOG3基因编码细胞分裂素合成通路上的限速酶,作用于最后一步将细胞分裂素转化为活性形式。同时TMO5/LHW的表达受限于木质部细胞,这里是细胞分裂素的合成位点,单其本身对于细胞分裂素不敏感。通过进一步使用细胞分裂素报告基因TCSn来分析组织水平的细胞分裂素信号在时空上的变化,结合数学建模,作者提出在木质部轴的高生长素区域可以作为整个维管束的组织者,而在这其中MP-TMO5-LOG4/5模块十分重要[5]。
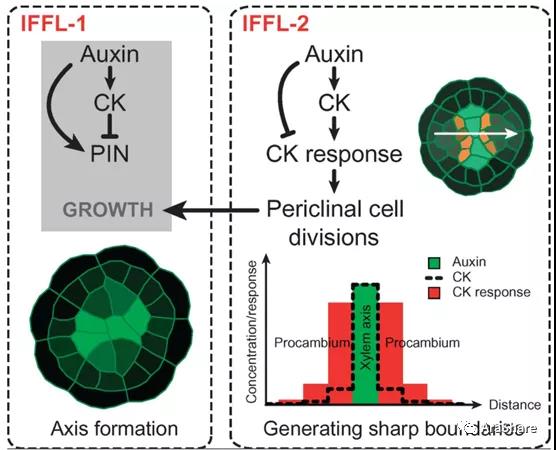
图7.维管组织形成过程中的激素信号的互作网络
遗传网络中的两个非连通的正反馈循环网络在空间上连通形成明显的边界效应。非连通的正反馈循环网络-1产生了一个高生长素区域,而非连通的正反馈循环网络-2产生了清晰的边界,如图所示,离散的模型表示CK浓度(虚线)和CK响应(形成层中红色条),根据距离生长素区域(木质部轴,绿色条)的距离。
在2019年,根特大学的Bert De Rybel 课题组(Dolf Weijers教授的博士生,是2014年Science的第一作者)在Currentbiology上发表了新的研究结果,揭示了木质部合成的细胞分裂素会扩散到邻近的原形成层细胞中,在这里,细胞分裂素通过诱导DOF类的转录因子促进细胞增殖。由于TMO5/LHW诱导产生的细胞分裂素作为中间移动信号,在邻近细胞中发挥作用,因此该激素信号级联下游的靶基因很有可能在木质部周边的多种类型细胞中表达,甚至有可能在维管束之外的地方[6]。
近期,根特大学的Bert De Rybel 课题组通过单细胞RNA测序(single cell RNA-sequencing, scRNA-seq)技术,测定了拟南芥根分生组织中组织特异性的TMO5/LHW信号转导的输出,发现该维管异源二聚体对于植物对磷缺乏条件的根毛响应是必需的。这项研究展示了细胞分裂素信号途径是如何连接磷缺乏的维管感知与表皮根毛响应,从而使得植物能够有效从土壤中觅食、吸收这种不会移动的大量营养元素[7]。
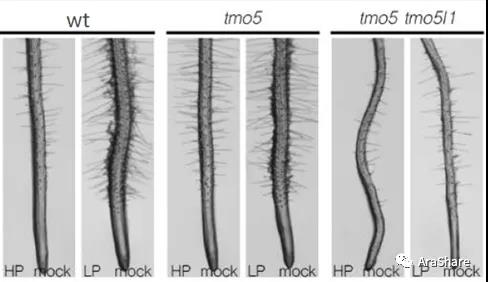
图8.tmo5tmo5l1双重突变体不能响应低磷条件诱导的根毛密度增加
6.蛋白调控网络
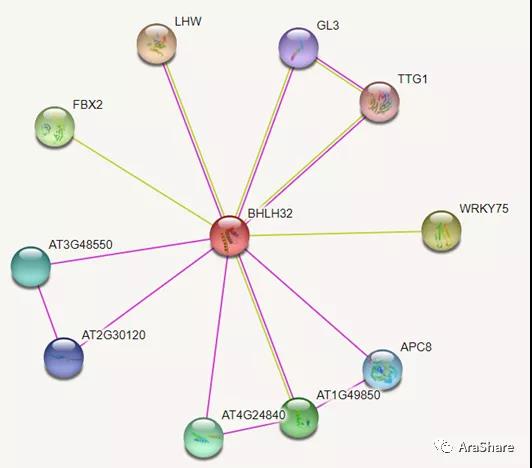
图9.拟南芥中TMO5蛋白互作网络预测(来自STRING)
如图9所示,TMO5蛋白互作网络已得到较好的剖析。TMO5家族会与LHW家族在体内互作形成异源二聚体介导下游基因表达;同时TMO5基因与许多三元复合物家族的关键因子有共表达,比如TTG1,表明TMO5在参与根毛命运决定中的重要作用。
7.其他物种研究情况简介
维管植物提供地球上大部分的生物量、食物以及饲料,然而对于该传导组织演化背后的分子创新还不清楚。在2019年,根特大学的Bert De Rybel 课题组揭示了异二聚体TMO5/LHW转录因子复合物的演化轨迹,这个复合物是拟南芥中维管细胞增殖的限速因子。这两个调控因子都起源于维管组织出现之前,甚至要早于现代植物的陆地化。研究表明TMO5在陆地植物起源时演化出了其现代的功能,包括能够与LHW二聚化。本文的研究结果揭示了维管细胞的分裂潜力可能是促成维管植物演化的重要因素[8]。
8.展望
早在2007年,通过表型筛选拟南芥幼苗对缺磷响应能力的相关转录因子,研究者鉴定到了TMO5作为对缺磷诱导的负调控因子,被命名为bhlh32[9]。但是为什么这类转录因子可以低磷诱导的根毛增多确没有给出合理解释。后续研究发现,尽管TMO5的表达模式主要限制在根的木质部中,但是通过与LHW互作形成异源二聚体调控了细胞分裂素合成重要的LOG4/5的表达,而细胞分裂素信号通路一方面促进细胞的平周和垂周分裂,介导了维管系统建成,另一方面细胞分裂素扩散通过下游的DOF2.1转录因子,影响到了外侧细胞层的命运决定。因此一对定位于木质部的转录因子,通过接受生长素信号促进表达,下游又激活细胞分裂素合成来指导维管系统建成和临近细胞的命运决定。不同的转录因子在空间和时间上特异表达是是如何汇聚的,如何进一步指导发育的过程,仍然是十分有意思的问题。是否有更多的转录因子来参与这一复杂过程的调控呢?结合单细胞测序技术的发展,更加精细的细胞表达谱结合时间轴必然可以带来更多全新的视角。
参考文献:
[1] Hardtke CS, Berleth T. The Arabidopsis gene MONOPTEROS encodesatranscription factor mediating embryo axis formation and vascular development.EMBOJ. 1998 Mar 2;17(5):1405-11.
[2] Ohashi-Ito K, Bergmann DC. Regulation of the Arabidopsis root vascular initial population by LONESOME HIGHWAY.Development. 2007 Aug;134(16):2959-68.
[3] De Rybel B,Möller B, Yoshida S, Grabowicz I, Barbier de Reuille P, Boeren S,Smith RS,Borst JW, Weijers D. A bHLH complex controls embryonic vascular tissue establishme nt and indeterminate growth in Arabidopsis. Dev Cell. 2013Feb25;24(4):426-37.
[4] Schlereth A,Möller B, Liu W, Kientz M, Flipse J, Rademacher EH, Schmid M,Jürgens G, WeijersD. MONOPTEROS controls embryonic root initiation byregulating a mobile transcription factor. Nature. 2010 Apr 8;464(7290):913-6.
[5] De Rybel B,Adibi M, Breda AS, Wendrich JR, Smit ME, Novák O, Yamaguchi N,Yoshida S, VanIsterdael G, Palovaara J, Nijsse B, Boekschoten MV, Hooiveld G,Beeckman T,Wagner D, Ljung K, Fleck C, Weijers D. Plant development Integration of growthand patterning during vascular tissue formation inArabidopsis. Science. 2014Aug 8;345(6197):1255215.
[6] Smet W, SevilemI, de Luis Balaguer MA, Wybouw B, Mor E, Miyashima S, Blob B,Roszak P, JacobsTB, Boekschoten M, Hooiveld G, Sozzani R, Helariutta Y, DeRybel B. DOF2.1Controls Cytokinin-Dependent Vascular Cell ProliferationDownstream of TMO5/LHW.Curr Biol. 2019 Feb 4;29(3):520-529.e6.
[7] Wendrich JR,Yang B, Vandamme N, Verstaen K, Smet W, Van de Velde C, Minne M,Wybouw B, MorE, Arents HE, Nolf J, Van Duyse J, Van Isterdael G, Maere S,Saeys Y, De RybelB. Vascular transcription factors guide plant epidermal responses to limiting phosphate conditions. Science. 2020 Sep 17:eaay4970.
[8] Lu KJ, van 'tWout Hofland N, Mor E, Mutte S, Abrahams P, Kato H, Vandepoele K,Weijers D, DeRybel B. Evolution of vascular plants through redeployment of ancient developmental regulators. Proc Natl Acad Sci U S A. 2020 Jan7;117(1):733-740.
[9] Chen ZH, NimmoGA, Jenkins GI, Nimmo HG. BHLH32 modulates several biochemical and morphological processes that respond to Pi starvation in Arabidopsis. Biochem J. 2007 Jul1;405(1):191-8.
本推文基于科学文献和网络资讯写作而成,未经领域内专家审阅;限于笔者学识水平,难免存在错漏,仅供参考!